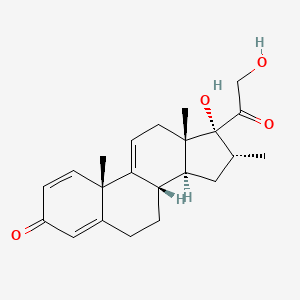
AGAMREE® (Vamorolone) компании Santhera Pharmaceuticals одобрен в ЕС для лечения мышечной дистрофии Дюшенна
Швейцарская фармацевтическая компания Santhera Pharmaceuticals объявила, что ее препарат AGAMREE® (Vamorolone) одобрен в Европейском Союзе (ЕС) для лечения мышечной дистрофии Дюшенна (Duchenne muscular dystrophy, DMD) у пациентов в возрасте 4 лет и старше, независимо от основной мутации и амбулаторного статуса.

Европейское агентство лекарственных средств (EMA) признало клинически важные преимущества безопасности AGAMREE в отношении поддержания нормального метаболизма, плотности и роста костей сравнительно со стандартными кортикостероидами. У пациентов, перешедших со стандартного лечения кортикостероидами на AGAMREE, наблюдалось восстановление роста и здоровья костей без потери эффективности.
Это делает AGAMREE® первым и единственным лекарственным препаратом, получившим полное одобрение в ЕС, а после одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в октябре — первым разрешенным препаратом, как в США, так и в ЕС, для лечения пациентов с DMD. Первый коммерческий запуск AGAMREE® в Германии ожидается в I квартале 2024 года.
«Мы очень рады получить одобрение ЕС на введение AGAMREE пациентам в ЕС, что подчеркивает благоприятный профиль безопасности и переносимости по сравнению с обычными кортикостероидами, включая преимущества для здоровья и роста костей», — заявил в интервью Дарио Эклунд (Dario Eklund), генеральный директор Santhera. «Наша команда сейчас сосредоточена на том, чтобы как можно скорее сделать AGAMREE доступным для пациентов с болезнью Дюшенна, а первый коммерческий запуск запланирован в Германии в I квартале 2024 года».
«Всемирная организация Дюшенна (World Duchenne Organization, WDO) с удовлетворением наблюдает закономерное развитие AGAMREE. В этом процессе принимали участие многие организации, объединяющие пациентов с этим опаснейшим заболеванием. Это обеспечило раннее финансирование и внесло свой вклад в дизайн клинических исследований (КИ), их результаты и набор персонала, что привело к первой полной авторизации на рынке Евросоюза лечения мышечной дистрофии Дюшенна», — отметила Элизабет Врум (Elizabeth Vroom), председатель WDO.
Одобрение ЕС было основано на данных положительного опорного КИ VISION-DMD и трех открытых исследований, в которых Vamorolone назначался в дозах от 2 до 6 мг/кг/день в течение 30 месяцев. В базовом КИ VISION-DMD у мальчиков, получавших Vamorolone, в среднем, сохранялся рост, аналогичный таковому у мальчиков, получавших плацебо, в то время, как у мальчиков, получавших prednisone, в среднем, наблюдалась задержка роста. Пациенты, перешедшие с prednisone на Vamorolone через 24 недели, в среднем, смогли возобновить рост в течение оставшейся части КИ.

В отличие от кортикостероидов, Vamorolone, по данным костных биомаркеров, не приводил к снижению метаболизма костной ткани, а также к значительному снижению минерализации костей в позвоночнике – по данным двойной энергетической рентгеновской абсорбциометрии (Dual Energy X-Ray Absorptiometry, DXA) после 48 недель КИ.
Santhera продолжит собирать данные для дальнейшей характеристики долгосрочной эффективности и более широкой дифференциации безопасности Vamorolone.
Решение ЕС последовало за положительным заключением Комитета по лекарственным препаратам для использования человеком (Committee for Medicinal Products for Human Use, CHMP) в отношении AGAMREE, объявленным 13 октября 2023 года. Разрешение на продажу будет действовать во всех 27 государствах-членах ЕС, а также в Исландии, Лихтенштейне и Норвегии.
27 октября 2023 г. Santhera объявила, что FDA одобрило пероральную суспензию AGAMREE в дозе 40 мг/мл в США для лечения DMD у пациентов в возрасте 2 лет и старше. Catalyst Pharmaceuticals владеет эксклюзивной лицензией на AGAMREE в Северной Америке и планирует запустить продукт в США в I квартале 2024 года.
О AGAMREE® (Vamorolone)
Vamorolone — это новый препарат, механизм действия которого основан на связывании с тем же рецептором, что у глюкокортикоидов, но модифицирует его последующую активность и не является субстратом для ферментов 11-β-гидроксистероиддегидрогеназы (11β-HSD), которые могут быть ответственны за местное повреждение тканей, амплификацию и кортикостероид-ассоциированную токсичность в местных тканях. Этот механизм продемонстрировал потенциал «диссоциации» эффективности от проблем безопасности стероидов, поэтому Vamorolone позиционируется, как альтернатива существующим кортикостероидам, текущему стандарту лечения детей и подростков с DMD.
AGAMREE® (vamorolone) имеет статус Orphan Drug в США и Европе, получил статусы Fast Track и Rare Pediatric Disease designations от FDA а также статус Promising Innovative Medicine (PIM) от UK MHA.

О мышечной дистрофии Дюшенна (DMD)
Мышечная дистрофия Дюшенна (DMD) — редкое наследственное заболевание, связанное с Х-хромосомой, поражающее исключительно мальчиков. DMD характеризуется воспалением, присутствующем уже при рождении или вскоре после него. Воспаление приводит к фиброзу мышц и клинически проявляется прогрессирующей мышечной дегенерацией и слабостью. По мере развития заболевания человек теряет способность передвигаться и самостоятельно питаться, у него развивается кардиомиопатия, и возникает необходимость в искусственной вентиляции легких. Чаще всего больные не доживают до 40 лет и умирают из-за дыхательной и/или сердечной недостаточности. Кортикостероиды являются современным стандартом лечения МДД.
О Santhera Pharmaceuticals
Santhera Pharmaceuticals — швейцарская специализированная фармацевтическая компания, занимающаяся разработкой и коммерциализацией инновационных лекарств для лечения редких нервно-мышечных и легочных заболеваний с высокими неудовлетворенными медицинскими потребностями. Основана в 2004 году, штаб-квартира находится в Праттельне (Швейцария). Компания имеет эксклюзивную лицензию от ReveraGen для всех показаний по всему миру на AGAMREE® (Vamorolone), диссоциативный стероид с новым механизмом действия, который был исследован в ключевом исследовании у пациентов с мышечной дистрофией Дюшенна в качестве альтернативы стандартным кортикостероидам. AGAMREE для лечения DMD одобрен FDA США и EMA ЕС, заявка на получение регистрационного удостоверения (MAA) находится на рассмотрении MHRA Великобритании. Santhera передала Catalyst Pharmaceuticals лицензионные права на Vamorolone в Северной Америке, а в Китае — Sperogenix Therapeutics. Клинический этап разработки также включает lonodelestat для лечения муковисцидоза и других нейтрофильных заболеваний легких.
Источник: https://pipelinereview.com/
19.12.2023