CRISPR-терапия помогла при наследственном ангионевротическом отеке в фазе I испытаний
Препарат вводят в организм однократно. Американские, британские, нидерландские и новозеландские исследователи сообщили об успехе первой фазы клинических испытаний in vivo CRISPR-терапии наследственного ангионевротического отека. Публикация об этом появилась в The New England Journal of Medicine.

Наследственный ангионевротический отек (НАО) встречается у одного из примерно 50 тысяч людей. Это опасное заболевание связано с мутациями генов SERPING1 (кодирует ингибитор C1-компонента системы комплемента) или F12 (кодирует фактор свертывания XII). Обе они приводят к неконтролируемому повышению уровня и выбросам калликреина и, как следствие, кининов. Клинически это проявляется сильными отеками рук, ног, лица, гортани и органов брюшной полости, что может привести к жизнеугрожающим состояниям — удушью и острому животу.
Такие приступы лечат только в стационаре, для их купирования применяют концентраты C1-ингибитора, свежезамороженную плазму, антагонист брадикининовых рецепторов икатибант, ингибиторы калликреина экаллантид, беротралстат и ланаделумаб, однако эффективность этих препаратов ограничена, и они (кроме плазмы) доступны далеко не во всех странах.
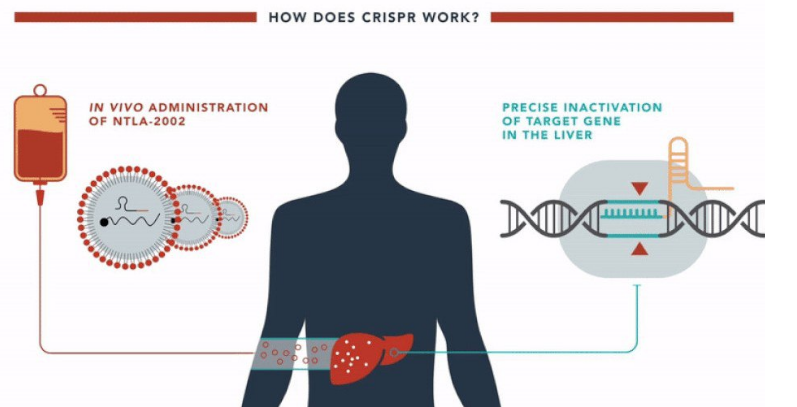
Препарат NTLA-2002, разработанный компанией Intellia Therapeutics, представляет собой упакованные в липидные наночастицы компоненты системы CRISPR/Cas9, которые при введении в организм выключают ген KLKB1, кодирующий плазменный прекалликреин (предшественник калликреина). Однократное введение должно обеспечивать пожизненный эффект.
В крыле первой фазы комбинированных клинических испытаний первой и второй фазы, проводимых Хилари Лонгхерст (Hilary Longhurst) из Оклендского университета с коллегами из Великобритании, Нидерландов, Новой Зеландии и США, три взрослых пациента с 1 или 2 типом НАО получили внутривенно инфузионно 25 миллиграмм NTLA-2002, четыре — 50 миллиграмм и еще три — 75 миллиграмм. Для профилактики острых реакций на сложный биологический препарат перед инфузией им дважды вводили глюкокортикоид и однократно блокаторы гистаминовых H1- и H2-рецепторов. Первичный период наблюдений за участниками длился 16 недель с последующим долгосрочным обсервационным периодом продолжительностью 88 недель.
На момент последнего обследования в конце обсервационного периода наблюдалось снижение плазменной концентрации калликреина в среднем на 67 процентов при дозе 25 миллиграмм, на 84 процента дозе 50 миллиграмм и на 95 процентов при дозе 75 миллиграмм по сравнению с исходным уровнем. К концу первичного периода наблюдений среднее количество приступов ангионевротического отека в месяц снизилось при этих дозировках в среднем на 91, 97 и 80 процентов соответственно. К завершению обсервационного периода этот показатель составил в среднем 95 процентов среди всех участников.
При использовании всех доз не наблюдалось тяжелых нежелательных событий и клинически значимых отклонений в лабораторных показателях, которые ограничивали бы использование NTLA-2002. Из побочных эффектов чаще всего встречались реакции на введение препарата и повышенная утомляемость.
Таким образом, в ходе первой фазы однократное введение NTLA-2002 приводило к устойчивому дозозависимому снижению плазменного уровня калликреина без серьезных побочных эффектов, а также выраженному уменьшению частоты приступов заболевания при всех режимах дозирования. Испытания I/II фазы продолжаются, начало глобальной III фазы запланировано на вторую половину 2024 года.
В ноябре 2023 года Великобритания впервые в мире одобрила клиническое применение терапии на основе CRISPR. Препарат применяется ex vivo для лечения наследственных анемий. Тремя неделями позже аналогичное решение приняли США, а спустя месяц зарегистрировали тот же препарат по второму показанию.
Источник: https://nplus1.ru
5.02.2024