FDA одобрило Olumiant от Lilly и Incyte для госпитализированных пациентов с COVID-19
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) дало разрешение на коммерциализацию препарата Olumiant (Олумиант, барицитиниб) от Lilly и Incyte, создав прецедент для лечения COVID-19.
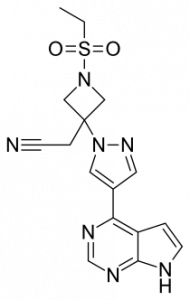
Лечение проводится один раз в день перорально. До одобрения Olumiant использовался для лечения COVID-19 в соответствии с разрешением FDA на экстренное использование (EUA). Olumiant — первый одобренный FDA ингибитор Янус-киназы (JAK), предназначенный для лечения госпитализированных пациентов с тяжелым COVID-19, которым требуется дополнительный кислород, экстракорпоральный мембранный кислород (ЭКМО) или использование аппарата ИВЛ.
FDA определило, что безопасность и эффективность Olumiant были в достаточной степени подтверждены клиническими исследованиями (КИ) фазы III адаптивного лечения COVID-19 2 (ACTT-2) и COV-Barrier. Первое спонсировалось Национальным институтом аллергии и инфекционных заболеваний, а исследование COV-Barrier спонсировалось Lilly.
Патрик Йонссон, старший вице-президент Lilly, президент Lilly Immunology и Lilly USA, а также главный специалист по работе с клиентами, прокомментировал важное достижение. «Препаратом Olumiant лечили почти миллион человек с COVID-19 примерно в 15 странах мира. Сегодняшнее полное одобрение FDA отражает как нашу уверенность в роли Olumiant в лечении этих госпитализированных пациентов, так и неустанные усилия Lilly по поддержке медицинского сообщества и пациентов в продолжающейся борьбе с COVID-19». Низкомолекулярные ингибиторы JAK манипулируют передачей сигналов JAK-STAT. Роль пути JAK-STAT в воспалительном ответе является идеальной мишенью для уменьшения симптомов воспаления. Тяжесть инфекции COVID-19 характеризуется степенью воспалительной реакции. Эти воспалительные реакции вызывают секрецию цитокинов, влияющих на клеточный ответ на воспаление. Olumiant прерывает передачу воспалительной реакции, вмешиваясь в активность цитокинов.
Главный исследователь ACTT-2 и профессор медицины Медицинского центра Университета Небраски Андре Калил, объяснил значение нового варианта лечения COVID-19. «Спустя более двух лет пандемии COVID-19 по-прежнему госпитализирует многих людей и осуществляет сильнейшее давлением на нашу систему здравоохранения. Я благодарен за то, что Olumiant стал признанным вариантом лечения для тех, кому требуется различная степень респираторной поддержки, от дополнительного кислорода до искусственной вентиляции легких. или ЭКМО», — сказал он. Путь к одобрению Olumiant FDA был долгим и извилистым, начиная с соглашения 2009 года между Lilly и Incyte о выявлении признаков воспалительных и аутоиммунных заболеваний. Olumiant имеет дополнительные разрешения, в том числе для применения при умеренном и тяжелом активном ревматоидном артрите. В Японии и Европейском союзе Olumiant одобрен для лечения атопического дерматита.
Источник: https://www.biospace.com/article/fda-approves-commercial-use-of-eli-lily-incyte-s-covid-treatment/
16.05.2022