FDA публикует окончательное отраслевое руководство по CAR-T и генной терапии
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) завершило разработку своего отраслевого руководства по продуктам химерных антигенных рецепторов (CAR)-Т-клеток и генной терапии, одновременно признав отсутствие прецедентов в этой области.

Новое руководство «Соображения по разработке клеточных продуктов CAR-T: руководство для промышленности» (Considerations for the Development of CAR-T Cell Products: Guidance for Industry) последовало за проектом, выпущенным в марте 2022 года и получившим отзывы от игроков отрасли, в том числе от Организации биотехнологических инноваций (Biotech Innovation Organization, BIO).
Игроки отрасли призвали Агентство более внимательно изучить роль производственных процессов, уточнить рекомендации по ранним стадиям испытаний и определить, как эти рекомендации применимы к другим методам лечения, помимо CAR-T.
Новое руководство не только фокусируется на продуктах CAR-T-клеток, но также может быть применено к другим генетически модифицированным продуктам лимфоцитов, включая клетки-естественные киллеры CAR (natural killer, NK) или Т-клетки, модифицированные рецептором Т-клеток (T cell receptor, TCR).
Кроме того, FDA также указывает на разные спецификации аллогенной и аутологичной терапии, подчеркивая важность данных о характеристиках во время ранних исследований.
Агентство приняло во внимание сложную природу разработки, производства и тестирования CAR-T-клеток, признав, что этот процесс включает в себя «сложные многоэтапные процедуры, которые являются потенциальными источниками различий между партиями продуктов».
«Соответствующее внутрипроизводственное тестирование в определенные моменты времени имеет жизненно важное значение для достижения и поддержания контроля над производственным процессом», — пишет FDA.
Рекомендации Агентства также включают доклиническое тестирование CAR-T-клеток, которое «может быть затруднительным из-за присущей этому типу продукта биологической сложности и изменчивости, а также ограниченной доступности подходящих животных моделей для проверки безопасности и активности», — заявили в FDA.
Имея это в виду, Агентство рекомендует стратегию в каждом конкретном случае и доступные доклинические и клинические знания о сопутствующих продуктах для поддержки использования CAR-T-клеток в предлагаемом исследовании.
Клинические рекомендации охватывали соображения, касающиеся ранних стадий онкологических исследований по оценке CAR-T, включая рекомендации по оценке безопасности и мониторингу.
BIO не согласился с проектом предложения: «Хорошо спланированные ранние клинические исследования имеют решающее значение для установления безопасности продукта, адекватности мер по снижению риска, взаимосвязи «доза-реакция», различий в оптимальной дозе, основанных на различиях в показаниях, предварительных данных об эффективности и осуществимости производства». Но FDA сохранило формулировку в итоговом документе с небольшими изменениями в сегменте мер по снижению рисков.
Новые рекомендации по безопасности последовали за месячным исследованием риска развития вторичного Т-клеточного рака у пациентов после приема препарата CAR-T.
Всего к концу 2023 года FDA зарегистрировало 22 случая Т-клеточного рака после лечения продуктом CAR-T.
Кроме того, Агентство также выпустило окончательную версию руководства по редактированию генов, которая специально нацелена на обеспечение наилучших процессов безопасности и качества при подаче заявки на новое исследовательское лекарство для исследуемых продуктов генной терапии.
Рекомендации FDA по редактированию генов являются «обычными», но все же важны, говорят аналитики.
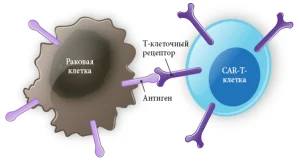
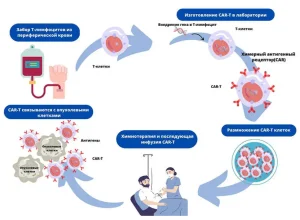
Что такое CAR-T-клеточная терапия
Клеточная терапия CAR-T — это инновационная и персонализированная иммунотерапия. Проще говоря, терапия, использующая собственную иммунную систему организма для уничтожения опухолевых клеток. Человеческая кровь состоит из тысяч различных видов клеток.
Терапия CAR-T-клетками – инновационный метод лечения определенных типов рака крови, при котором собственные лейкоциты пациента генетически программируются на уничтожение раковых клеток. При помощи высокотехнологичного оборудования осуществляется отделение лейкоцитов (белых кровяных клеток, которые являются важным компонентом иммунной системы) от остальной массы крови. В специализированной лаборатории полученные лейкоциты претерпевают генетическую модификацию с целью экспрессии химерных антигенных рецепторов (CAR). На следующем этапе их размножают в лабораторных условиях до достижения миллионов модифицированных клеток и возвращают в организм пациента.
Возвращение CAR-T-клеток в кровоток пациента осуществляется путем инфузии. Теперь химерные антигенные рецепторы будут помогать генетически модифицированным клеткам связываться с соответствующими антигенами раковых клеток, эффективно выслеживая и уничтожая их.
Источник: https://www.pmlive.com/
Источник: https://www.fiercebiotech.com/
Источник: https://www.mskcc.org/
2.02.2024