Новые лекарства: что тормозит рост инноваций?
Выявлено, что более половины новых лекарственных препаратов, поступающих в систему здравоохранения Германии, не приносят пользы. Беате Вислер и ее коллеги полагают, что международные правила и процедуры разработки лекарственных препаратов неэффективны и требуют изменения.
Агентства по регулированию лекарственных препаратов по всему миру стремятся ускорять разработку лекарств и выдачу разрешений на их использование.[1,2] Они считают, что быстрый доступ к новым лекарствам полезен пациентам. Пропаганда новизны и инноваций создает впечатление, что новые продукты лучше существующих.
Тем не менее, исследование показывает, что, несмотря на безусловную потребность в новых терапевтических средствах, лишь немногие лекарства, введенные в оборот с 1970-х гг., превосходят существующие по своим качествам.[3-9] Большинство исследований показывает, что доля действительно инновационных разработок составляет менее 15% и не увеличивается с течением времени.
Преимущества большинства новых лекарственных препаратов не доказаны
Согласно законодательству, оценка медицинских технологий в Германии осуществляется Институтом качества и эффективности здравоохранения, который обязан исследовать преимущества новых лекарств перед стандартными. Классификация дополнительных преимуществ (незначительные, значительные и важные) зависит от степени и масштаба лечебного эффекта и влияет на стоимость и назначение препаратов (вставка 1).
Вставка 1
Ранняя оценка преимуществ новых лекарственных препаратов в Германии
1 января 2011 г. в результате реформы законодательства, регулировавшего рынок лекарственных средств, в Германии была введена система ранней оценки преимуществ новых лекарственных препаратов перед стандартными. Проведение оценки и принятие окончательного решения о наличии таких преимуществ осуществляется главным государственным органом системы здравоохранения Германии — Федеральной межведомственной комиссией.
Эта комиссия определяет стандартное медицинское обслуживание в соответствии с критериями, предусмотренными в законодательстве. Согласно этим критериям, стандартное медицинское обслуживание представляет из себя разрешенные для применения в медицинской практике и оплачиваемые процедуры, эффективность которых подтверждена стандартами доказательной медицины (преимущественно основанными на исследованиях результатов лечения). К стандартному медицинскому обслуживанию также могут относиться динамическое наблюдение и симптоматическая терапия.
Как правило, преимущество нового лекарственного препарата перед стандартным определяется методом прямого или косвенного сравнения (допускаются только адаптированные косвенные сравнения с использованием подходящих общих компараторов [10]) по показателям смертности, заболеваемости (в том числе — побочных явлений) или качества жизни, определяемого здоровьем.
Оценке подлежит разрешение для применения в медицинской практике как новых лекарственных препаратов, так и стандартно используемых средств. Для орфанных препаратов с прибылью менее 50 млн. евро (45 млн. фунтов стерлингов, 57 млн. долларов США) в год, предусмотрена отдельная процедура оценки; в настоящем анализе эти препараты не рассматривались.
Процедура
Когда новый разрешенный к применению препарат выходит на немецкий рынок, соответствующая фармацевтическая компания обязана предоставить Федеральной межведомственной комиссии стандартное досье со всеми доказательствами преимущества нового препарата перед стандартным. Как правило, комиссия поручает Институту качества и эффективности здравоохранения оценить доказательства, приведенные в досье, в течение трех месяцев с момента выхода лекарства на рынок. По результатам этой оценки комиссия принимает решения о наличии преимущества у нового препарата. После того, как Институт качества и эффективности здравоохранения публикует отчет об оценке, комиссия проводит слушания, в ходе которых фармацевтическая компания и другие участники могут обсудить ее результаты. По окончании обсуждения Федеральная межведомственная комиссия принимает решение о вероятности и степени преимущества нового препарата. Иногда окончательное решение отличается от результатов оценки Института качества и эффективности здравоохранения. Федеральная межведомственная комиссия приняла следующие решения по 216 оценкам, описанным в настоящей статье: преимущества отсутствуют – 115 из 216 (53%); имеется важное преимущество – 1 из 216 (1%); имеется значительное преимущество – 55 из 216 (25%); имеется незначительное преимущество – 33 из 216 (15%), имеется преимущество, не поддающееся количественному измерению: 12 из 216 (6%), имеется недостаток: 0 из 216 (0%) (https://www.gba.de/informationen/nutzenbewertung/).
Заключение о наличии преимущества используется для согласования цены между главной организацией по обязательному медицинскому страхованию и фармацевтической компанией. Даже если Федеральная межведомственная комиссия принимает заключение об отсутствии преимущества у нового препарата, его продажа не запрещается, однако его стоимость, как правило, не должна превышать стоимость стандартного препарата. Заключение о наличии преимущества у препарата также может значительно влиять на медицинское обслуживание, поскольку врачи могут использовать этот препарат в клинических рекомендациях и назначать его конкретным пациентам.
С 2011 по 2017 гг. Институт качества и эффективности здравоохранения оценил 216 препаратов, в том числе 152 новых химических соединений и 64 лекарства, разрешенных к продаже в Германии. Поскольку Европейское агентство лекарственных средств разрешило использовать почти все эти препараты в Европе, наши результаты также позволяют оценить европейские процедуры и правила разработки лекарств.
Выяснилось, что только 54 из 216 (25%) оцененных препаратов имеют важное или значительное преимущество перед существующими. Преимущество 35 (16%) препаратов незначительно или не поддается количественной оценке. Имеющиеся доказательства не подтверждают наличие преимущества у 125 новых препаратов (58%) перед стандартными по показателям смертности, заболеваемости и качества жизни, обусловленного здоровьем, среди обследованной группы пациентов (рис. 1). В таблице 1 приведены примеры результатов оценки по категориям преимуществ. Поскольку лечебный эффект препаратов часто зависит от конкретных пациентов, возможны ситуации, в которых препарат не оказывает значительного эффекта на исследуемую группу пациентов в целом, но положительно влияет на некоторые ее подгруппы. Тем не менее, Институт качества и эффективности здравоохранения учитывает результаты для подгрупп пациентов по возрасту, полу, тяжести заболевания и другим факторам, специфичным для конкретных заболеваний. Среди 89 препаратов, имеющих преимущество, 52 (58%) продемонстрировали это преимущество во всей группе пациентов, а 37 (42%) — в некоторых подгруппах.
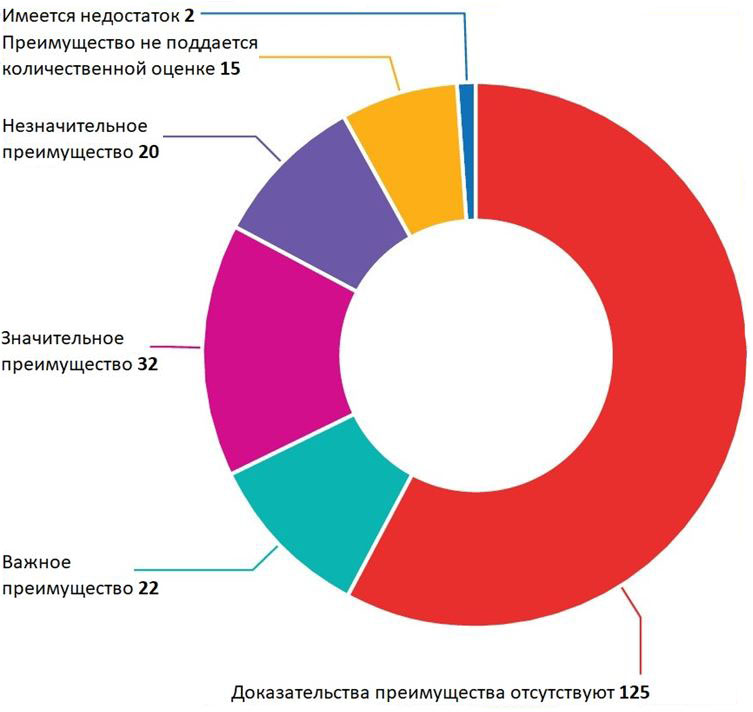
Рис. 1
Оценка преимущества новых лекарств на рынке Германии за 2011-2017 гг. (указано максимальное преимущество среди групп пациентов. Доказательством считается статистически значимое преимущество для пациента при рандомизированном клиническом исследовании или сверхбольшое преимущество при нерандомизированном исследовании).
Таблица 1. Примеры оценок положительного воздействия на пациентов, проведенных Институтом качества и эффективности здравоохранения, для различных категорий преимущества*
В некоторых специализациях сложилась совершенно очевидная ситуация. Например, в психиатрии/неврологии и лечении сахарного диабета преимущество было обнаружено лишь в 6% (1 из 18) и 17% (4 из 24) оценок соответственно (рис. 2). Возможно, это объясняется тем, что регуляторы по-прежнему разрешают проводить плацебо-контролируемые исследования вопреки многолетним рекомендациям медицинских аналитических органов проводить исследования с активным контролем, которые предоставляют гораздо больше полезной информации. [13-15] На рис. 2 также показано, что разработка и разрешение лекарств для борьбы с различными заболеваниями ведутся с разной интенсивностью, и наибольшее число лекарств приходится на онкологические заболевания.
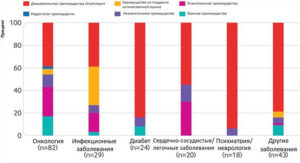
Рис. 2
Результаты оценки преимущества новых лекарств, поступивших на рынок Германии в 2011-2017 гг., перед существующими лекарствами по категориям заболеваний.
Что это означает для европейского фармацевтического рынка? Только два лекарства (1%) оказались хуже существующих, однако данных о 125 лекарствах недостаточно, чтобы сделать выводы. Исследования для сравнения 64 новых лекарств с существующими не проводились. Еще 42 лекарства сравнивались с неподходящим активным компаратором (использовались не по инструкции или с нарушением дозировки). Сравнение [19] оставшихся лекарств с существующими было корректным, но не выявило преимущество или явный недостаток новых лекарств.
Заблуждения о послерегистрационной информации о лекарствах
Некоторые специалисты считают, что недостаток информации на момент разрешения лекарства (а, следовательно, его широкое применение пациентами) — цена, которую необходимо платить за раннюю доступность инновационных лекарств. Согласно этой позиции, исследования после регистрации препарата, в конечном счете, должны подтверждать преимущества препарата для пациентов. [16]
Тем не менее, в действительности ситуация выглядит совершенно иначе. Например, систематическая оценка показала, что в 2009-2013 гг. EMA разрешала использование большинства противораковых препаратов без клинически доказанных преимуществ для пациентов (снижения смертности и повышения качества жизни); спустя несколько лет ситуация принципиально не изменилась. [17] Еще большее беспокойство вызывают результаты систематической оценки новых лекарств для более чем 100 видов заболеваний, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США без доказательств клинической эффективности. Согласно этим результатам, лекарства оказались клинически эффективными менее, чем в 10% случаев. [18] Более высокий, но недостаточный показатель (20%) был опубликован в аналогичном исследовании противораковых препаратов. [19]
Несмотря на данное обещание, важной и широко известной проблемой остается то, что пост-маркетинговые исследования часто не проводятся. Анализ показал, что лишь около половины таких исследований были проведены своевременно [20] или в течение 5-6 лет. [21] В Германии складывается аналогичная ситуация: ни одно из шести исследований, затребованных для повторной оценки внедренных медицинских технологий в 2011-2017 гг., не было проведено. В различных странах мира регуляторы не принимают почти никаких санкционных мер к компаниям-нарушителям.
Терапевтические аналоги
Несмотря на то, что на сегодняшний день термин «терапевтические аналоги» используется относительно редко, несколько новых лекарств, обладающих преимуществами в лечении онкологических и инфекционных заболеваний, имеют одинаковый механизм действия. Это свидетельствует о том, что после создания коммерчески успешного препарата с новым принципом действия, появляются несколько похожих, а не принципиально новых препаратов. Например, анализ Института качества и эффективности здравоохранения показал, что в Германии 12 из 48 (25%) успешных оценок в онкологии приходятся на ингибиторы PD-1 и PD-L1. Во всех лекарствах, показавших преимущества при лечении гепатита C, используется один из трех типов прямого противовирусного действия или их сочетание.
Анализ планов разработки лекарств демонстрирует аналогичную тенденцию. Международное исследование текущих и запланированных испытаний в сфере иммуноонкологии выявило большое количество испытаний лекарств идентичного назначения, в том числе других ингибиторов PD-1 и PD-L1. [22] Эти результаты вызывают не только сомнения в эффективности процесса разработки лекарственных препаратов, но и подозрения, что текущие испытания препятствуют эффективному созданию новых лекарств, вовлекают большое количество пациентов в апробацию терапевтических аналогов (в лучшем случае), становятся причиной непроизводительных затрат на разработку дублирующих лекарств и не способствуют созданию методов лечения с инновационными принципами действия, направленных на широкие группы пациентов. Терапевтические аналоги подвергаются критике как главное препятствие серьезному прогрессу в здравоохранении. [23]
Кроме того, установлено, что новые геномные методы лечения рака, на которые приходится значительная доля лекарственных средств, показавших наличие преимуществ в наших оценках, повышают эффективность лечения поздних стадий рака лишь менее, чем в половине случаев. [24] В масштабе всей обследованной группы пациентов эффект от разработки лекарств может быть еще ниже.
Воздействие на пациентов и систему здравоохранения
Врачи и пациенты должны получать объективную и полную информацию об ожидаемых результатах лечения, в том числе — о преимуществах альтернативных методов лечения или его отсутствии. Тем не менее, это невозможно из-за существующей нехватки информации. Таким образом, пациенты ограничены в возможности выбирать методы лечения согласно своим предпочтениям, [25] а любая система здравоохранения, заявляющая о своей «ориентации на пациента», оказывается неспособной соблюдать свои этические обязательства. [26, 27]
Отсутствие необходимой информации вредит и здравоохранению. Неясность преимуществ конкретного метода лечения создает риск некачественного медицинского обслуживания и препятствует принятию решений (в особенности — при покупке дорогостоящих препаратов в сложных экономических условиях).
Новый подход
Поскольку разработка, разрешение, оплата лекарств и определение цен на них строго регламентированы, текущее состояние дел говорит о неэффективности действующих правил. Нам нужны новые подходы.
Мы убеждены, что регуляторы должны гораздо строже относиться к сокращенным программам разработки лекарств. Им следует вернуться к прежним правилам, требовать надежных доказательств эффективности и безопасности за длительный период времени, а также достаточно длительной фазы III в рандомизированных клинических исследованиях. Это одновременно обеспечит возможность сбора данных для оценки медицинских технологий. Этот подход можно реализовать с помощью действующего законодательства. Кроме того, учитывая влияние законодательных решений на множество систем здравоохранения, подход к регулированию должен определяться всеми организациями, ответственными за качество медицинского обслуживания.
Чтобы восполнить недостаток информации, можно ввести обязательные испытания с активным контролем — если не для выдачи разрешений на использование препаратов, то хотя бы для изучения их преимуществ при оценке медицинских технологий и в клинической практике. Текущая законодательная инициатива по оценке медицинских технологий в Европе позволяет реализовать эти требования [28] и увеличить количество доступной информации о новых лекарственных препаратах.
Одновременно решения о возмещении затрат на лекарства и образовании цен на них должны воспрепятствовать неэффективному лечению пациентов [29, 30] и использованию ненадежных доказательств, а также стимулировать рост эффективности лечения. Первые шаги по определению желаемых результатов уже сделаны; американские и европейские сообщества онкологов разработали принципы оценки преимуществ и эффективности методов лечения. [31, 32] Эти принципы можно использовать как основу для обсуждений и применять их к другим видам заболеваний. Участие пациентов в этих обсуждениях является обязательным. [33] Итоги обсуждений желаемых результатов должны учитываться при принятии законодательных решений.
В долгосрочной перспективе высшим чиновникам в сфере здравоохранения следует действовать на упреждение. Вместо того, чтобы ждать, пока фармацевтические компании решат, какие препараты разрабатывать, они могут формулировать требования системы здравоохранения и принимать меры для их реализации. Примером нового подхода служат инициативы по разработке новых антибиотиков, в том числе под руководством Всемирной Организации Здоровья, в которых определены приоритетные патогены, проанализированы технологии проектирования, а также разработаны и проведены клинические испытания при участии коммерческих и некоммерческих партнеров. [34] Первое, что необходимо сделать — провести общий анализ процессов разработки лекарственных препаратов на европейском уровне с учетом текущих и будущих заболеваний; это поможет высшим чиновникам выполнить необходимые исследования и привести разработку лекарств в соответствие с потребностями населения.
Важной составляющей решения актуальных задач являются новые модели разработки лекарственных препаратов. Эти модели позволяют создавать лекарства для лечения заболеваний, которым не уделяется достаточное внимание, а также обеспечивать устойчивое развитие систем здравоохранения. Некоторые из таких моделей обсуждаются или уже разработаны. [35 — 37] Модель разработки лекарств для программы «Лекарства для забытых болезней» (Drugs for Neglected Diseases initiative, DNDi) основана на профилях целевых продуктов, предназначенных для лечения конкретных заболеваний. Эта модель также обеспечивает доступ к новым методам лечения и знаниям. Она основана на финансовой и научной независимости DNDi и сотрудничестве между государственными и частными партнерами. [35] В совместном проекте бельгийского и датского агентств по оценке медицинских технологий, посвященном будущим возможностям разработки лекарств, предложены частно-государственное партнерство и некоммерческая разработка необходимых лекарств, а также новые модели для фармацевтической отрасли, такие как «плати за патенты» и государственное фармацевтическое предприятие. [36]
Для повышения эффективности, качества и актуальности разработки лекарств также предложено использовать модель с открытым исходным кодом. [37] Потенциальные выгоды доступности данных для всего терапевтического сообщества, которые обеспечит эта модель, недавно были продемонстрированы в проекте по борьбе с болезнью Альцгеймера. Несмотря на то, что среди участников этого проекта были только регуляторы, к нему можно привлекать и другие организации. [38]
Целевая политика здравоохранения на основе фактов
Процесс выбора целей в здравоохранении в значительной степени политизирован, однако правила использования лекарственных средств должны основываться на конкретных целях, относящихся к состоянию здоровья населения. Необходимо разработать новые подходы, используя данные об эффективности существующих правил. Результаты изменения правил следует сопоставлять с целями и при необходимости вносить корректировки.
В заключение следует отметить, что текущих процедур и правил разработки лекарственных средств в Европе недостаточно. Необходимо совместными усилиями, на уровне ЕС и отдельных государств, определить целевые показатели здоровья населения, пересмотреть нормативно-правовую базу, внедрить новые модели разработки лекарственных препаратов для реализации поставленных целей и сконцентрировать усилия на главном аспекте здравоохранения — потребностях пациентов.
Основные выводы
· Преимущества более половины новых лекарств в Германии перед существующими не доказаны
· Для стимулирования инноваций необходимо обязать производителей предоставлять сравнительные данные на этапе разрешения лекарственного препарата
· Это позволяет плательщикам устанавливать цену и возмещение на выгодном для пациентов уровне
· Совместные действия на уровне ЕС и отдельных государств необходимы для пересмотра нормативно-правовой базы, внедрения новых моделей разработки лекарственных средств и концентрации усилий на удовлетворении нужд пациентов
Благодарности
Мы благодарим Флорину Кекерес (Florina Kerekes), Грегора Морица (Gregor Moritz) и Клаудию Сельбахер (Claudia Selbach) за помощь в настройке базы данных и извлечении данных. Мы также благодарим Питера Доши (Peter Doshi) за изучение рукописи и полезные предложения.
Сноски
· Авторы и источники: все авторы работают в различных сферах оценки медицинских технологий. БВ и ТК участвовали в разработке концепции анализа и анализировали данные; БВ написала черновой вариант рукописи; НМ участвовала в создании рукописи. Все авторы прочли рукопись и одобрили окончательную версию. Поручителем является БВ.
· Конфликт интересов: Мы ознакомились с политикой декларирования интересов BMJ и поняли ее содержание. У нас нет интересов, подлежащих декларированию.
· Проверка происхождения и дружественная проверка: не проводилась; проведена внешняя дружественная проверка.
Опубликовано 10 июля 2019 г.
Беате Вислер (Beate Wieseler), руководитель отдела исследований лекарственных препаратов, Натали МакГауран (Natalie McGauran), аналитик, Томас Кайзер (Thomas Kaiser), руководитель отдела исследований лекарственных препаратов. Институт качества и эффективности здравоохранения (г. Кельн, Германия). Получатель корреспонденции: Б. Вислер (B Wieseler) beate.wieseler@iqwig.de
Источник: https://www.bmj.com/content/366/bmj.l4340
BMJ 2019; 366 doi: https://doi.org/10.1136/bmj.l4340 (Published 10 July 2019)
18.07.2019