Pfizer объявляет об одобрении FDA комбинации Braftovi/Mektovi при раке легких
Компания Pfizer объявила, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило новый вариант персонализированного лечения для некоторых пациентов с раком легких: комбинацию препаратов Braftovi (encorafenib) плюс Mektovi (binimetinib) . Решение регулятора касается взрослых с метастатическим немелкоклеточным раком легких (non-small cell lung cancer, NSCLC) с мутацией BRAF V600E, обнаруженной с помощью теста, также получившего одобрение FDA.
Рак легких является вторым наиболее распространенным типом рака, и на NSCLC приходится до 85% всех случаев рака легких.
Некоторые виды рака легких связаны с приобретенными генетическими аномалиями, такими как мутация BRAF V600E, которая встречается примерно в 2% случаев NSCLC.
«Мутации BRAF V600E идентифицируют уникальный подтип метастатического NSCLC, представляющего собой действенный биомаркер, с которым могут помочь точные лекарства, такие как комбинированная терапия Braftovi/Mektovi», — объяснил Грегори Рили (Gregory Riely), работающий в продолжающемся промежуточном клиническом исследовании (КИ) PHAROS, поддержанным одобрением FDA.
Исследование, в котором оценивается комбинированная терапия как у ранее не получавших лечения, так и у пациентов с метастатическим NSCLC с мутацией BRAF V600E, достигло основных показателей эффективности, таких как частота объективного ответа и продолжительность ответа в обеих группах лечения.
«Исследование PHAROS продемонстрировало, что эти пациенты могут получить пользу от таргетной терапии Braftovi/Mektovi независимо от истории их предыдущего лечения», — отметил Рили. «Учитывая конкретный профиль эффективности и безопасности, у пациентов и поставщиков теперь есть еще одна возможность помочь персонализировать планы лечения, взяв за основу индивидуальные факторы риска и предпочтения».
Комбинация Braftovi/Mektovi также одобрена FDA для лечения пациентов с неоперабельной или метастатической меланомой с мутацией BRAF V600E или V600K, а Braftovi одобрен в сочетании с cetuximab для лечения взрослых с метастатическим колоректальным раком с мутацией BRAF V600E.
Крис Бошофф (Chris Boshoff), исполнительный вице-президент Pfizer и главный специалист по исследованиям и разработкам в области онкологии заявил в интервью: «С момента первоначального одобрения FDA в 2018 году комбинированная терапия Braftovi/Mektovi помогла тысячам людей, живущих с BRAF V600E- или V600K-мутантной неоперабельной или метастатической меланомой. Мы надеемся помочь еще большему количеству пациентов с помощью нашей целевой комбинированной терапии Braftovi/Mektovi».

Pfizer обладает эксклюзивными правами на Braftovi и Mektovi в США, Канаде и всех странах Латинской Америки, Африки и Ближнего Востока, эксклюзивные права на оба продукта в Японии и Южной Корее принадлежат Ono Pharmaceutical, Medison имеет эксклюзивные права только в Израиле, а Pierre Fabre обладает эксклюзивными правами во всех других странах.
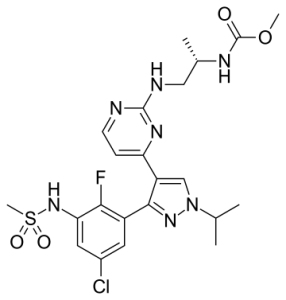
Encorafenib
Encorafenib, брендовое название Braftovi, представляет собой лекарство для лечения некоторых видов меланомы. Это низкомолекулярный ингибитор BRAF, воздействующий на ключевые ферменты сигнального пути MAPK. Такой путь встречается при многих различных видах рака, включая меланому и колоректальный рак. Вещество разрабатывала компания Novartis, а затем Array BioPharma. В июне 2018 года FDA одобрило encorafenib в сочетании с binimetinib для лечения пациентов с неоперабельной или метастатической меланомой с мутацией BRAF V600E или V600K. Наиболее частые (≥25%) побочные реакции включают усталость, тошноту, диарею, рвоту, боль в животе и артралгию.

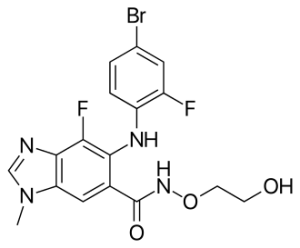
Binimetinib
Binimetinib, противораковый препарат, продаваемый под торговой маркой Mektovi, используется для лечения различных видов рака. Binimetinib является селективным ингибитором МЕК, центральной киназы в пути МАРК, способствующего развитию опухолей. Было показано, что несоответствующая активация этого пути происходит при многих видах рака. В июне 2018 года FDA одобрило его в сочетании с encorafenib для лечения пациентов с неоперабельной или метастатической меланомой с мутацией BRAF V600E или V600K. В октябре 2023 года FDA одобрило его для лечения NSCLC с мутацией BRAF V600E в сочетании с encorafenib.
Источник: https://www.pmlive.com/
Источник: https://www.braftovimektovi.com/
16.10.2023