Покупка Bristol Myers Squibb компании Turning Point Therapeutics за $4,1 млрд обеспечила одобрение FDA препарата Augtyro от рака легких
Одобрение FDA препарата Augtyro (repotrectinib) дает Bristol Myers Squibb возможность бросить вызов фармацевтическим гигантам Pfizer и Roche в борьбе с ROS1-положительным немелкоклеточным раком легкого. Благодаря приобретению Turning Point Therapeutics, компании-разработчика Augtyro, Bristol Myers Squibb выходит на нишевый рынок лечения рака легких.

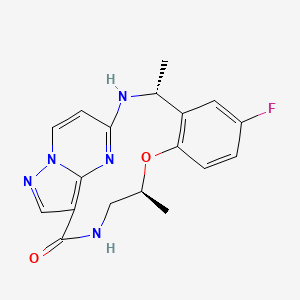
FDA одобрило repotrectinib компании Bristol Myers под торговой маркой Augtyro для лечения пациентов с немелкоклеточным раком легких (non-small cell lung cancer, NSCLC), опухоли которых имеют онкогенные слияния ROS1. Фармацевтическая компания из Нью-Джерси заявила, что планирует сделать препарат доступным начиная с середины декабря.
BMS заполучила Augtyro в свой портфель благодаря приобретению в прошлом году Turning Point Therapeutics за $4,1 млрд. А одобрение, полученное в среду, 15 ноября, дает BMS возможность бросить вызов препаратам Xalkori от Pfizer и Rozlytrek от Roche в отношении ROS1-положительного NSCLC, на который приходится от 1% до 2% от всех случаев NSCLC.
Аналитики Leerink Partners во время сделки с Turning Point прогнозировали, что продажи Augtyro могут достичь $1,4 млрд на пике продаж в первой линии и в $455 млн во второй.
Данные клинических исследований (КИ) показывают, что Augtyro способен стать новым стандартом лечения этого подтипа NSCLC, заявила Джессика Лин (Jessica Lin), доктор медицины из Массачусетской больницы общего профиля (Massachusetts General Hospital).
Доктор Лин руководила КИ компании BMS TRIDENT-1. В этом одногрупповом исследовании фазы 1/2 Augtyro уменьшил опухоли у 79% пациентов, не получавших до этого ингибитор тирозинкиназы (tyrosine kinase inhibitor, TKI), такой как Augtyro, при этом ответ длился в среднем 34,1 месяца. Для сравнения – среди тех, кто предварительно лечился одним агентом ROS1, но не проходил химиотерапию, общий уровень ответа составил 38%, а его продолжительность в среднем составляла 14,8 месяцев.

Препарат также показал способность сдерживать опухоли, распространившиеся на мозг. Исследователи наблюдали реакцию головного мозга у семи из восьми пациентов, ранее не принимавших TKI, с измеримыми метастазами в центральной нервной системе и у пяти из 12 пациентов, ранее получавших TKI.
ROS1-положительный NSCLC является одним из немногих показаний к раку, при котором данных об уменьшении опухоли было достаточно, чтобы поддержать полное одобрение FDA. Xalkori компании Pfizer стал первым TKI, получившим разрешение на такое использование, основываясь на объективной частоте ответа у 66% из 60 пациентов, включенных в КИ фазы 1. Средняя продолжительность ответа составила 18,3 месяца.
Препарат Roche Rozlytrek вышел на рынок в 2019 году, продемонстрировав показатель ответа на опухоль в ходе КИ, равный 78% среди 51 пациента. Ответы сохранялись в течение как минимум года у 55% пациентов.
Согласно статье в JCO Oncology Practice, написанной двумя врачами клиники Майо, до одобрения Augtyro Xalkori был методом выбора при запущенном ROS1-положительном NSCLC (без метастазов в ЦНС), тогда как Rozlytrek является предпочтительным вариантом для пациентов с метастазами в ЦНС.
Несмотря на то, что Rozlytrek имеет дополнительные показания для лечения солидных опухолей, положительных по слиянию NTRK-генов, за первые 9 месяцев 2023 года объем продаж Rozlytrek составил всего 63 млн швейцарских франков ($71 млн). В свою очередь, BMS также тестирует в фазе 2 Augtyro на солидных опухолях NTRK.
Xalkori (одобрен FDA в 2022 году) также разрешено лечить ALK-положительный NSCLC, но, отчасти благодаря препарату Lorbrena (lorlatinib) от Pfizer, одобренному FDA в марте 2021 года. Продажи более старого TKI упали на 27% в годовом исчислении до $86 млн в течение первых трех кварталов года.
Учитывая низкий уровень продаж этих более ранних препаратов, может быть трудно представить себе рыночный потенциал блокбастера для Augtyro. А аналитики Leerink еще в июне 2022 года признали, что многие инвесторы не разделяют их оптимизма.
Однако Augtyro имеет еще одно преимущество перед конкурентами. Одна из проблем с предложениями Pfizer и Roche заключается в том, что они не смогли преодолеть распространенную мутацию устойчивости ROS1-положительного NSCLC под названием G2032R. Для сравнения, Augtyro, похоже, смог справиться с G2032R, на долю которого приходится 41% резистентных мутаций при ROS1-положительном NSCLC.
С точки зрения безопасности, профиль побочных эффектов Augtyro во многом соответствует показателям двух его конкурентов, сообщили аналитики компании William Blair&Company в четверг. Но в исследовании Augtyro, наряду с сильной активностью ЦНС наблюдается высокий уровень головокружения, и аналитики заявили, что будут продолжать следить за этим моментом. Команда отметила, что некоторые случаи были достаточно серьезными, чтобы потребовать прерывания или снижения дозы.
На этикетке Augtyro нет предупреждений о продлении интервала QT, как в случае с Xalkori и Rozlytrek.
Учитывая все вышесказанное, William Blair сохранил прогноз, что продажи Augtyro к 2027 году достигнут $258 млн, что также предполагает одобрение в Европе в следующем году.
В последнее время BMS оказалась в затруднительном положении: самые продаваемые лекарства и ключевые запуски разочаровывают инвесторов. Вот почему компания снова обращается к сделкам, согласившись купить производителя лекарств Mirati Therapeutics за $5,8 млрд.

О Turning Point Therapeutics Inc.
Turning Point Therapeutics — компания, занимающаяся прецизионной онкологией на клинической стадии, располагающая линейкой экспериментальных препаратов, предназначенных для устранения ключевых ограничений существующих методов лечения рака. Ведущий кандидат на лекарство компании, repotrectinib, представляет собой ингибитор киназы нового поколения, нацеленный на онкогенные факторы ROS1 и TRK, вызывающие немелкоклеточный рак легких и распространенные солидные опухоли.
В портфель потенциальных лекарств Turning Point также входит elzovantinib, нацеленный на MET, CSF1R и SRC, изучаемый в КИ фазы 1 на пациентах с распространенными или метастатическими солидными опухолями, несущими генетические изменения в MET; TPX-0046, нацеленный на RET, изучается в КИ фазы 1/2 у пациентов с распространенными или метастатическими солидными опухолями, несущими генетические изменения в RET; TPX-0131, ингибитор ALK следующего поколения, изучается в КИ фазы 1/2 на ранее лечившихся пациентах с ALK-положительным распространенным или метастатическим немелкоклеточным раком легкого; и TPX-4589 (LM-302), новый ADC, нацеленный на Claudin18.2, рассматриваемый в КИ фазы 1 при раке желудочно-кишечного тракта. Turning Point стремится разработать методы лечения, которые станут поворотным моментом для пациентов в лечении рака.
Источник: https://www.fiercepharma.com/
Источник: https://www.globenewswire.com/
Источник: https://ascopost.com/
20.11.2023