Более 760 пациентов включили в клинические исследования ремдесивира в Китае
Была одобрена заявка на проведение клинических испытаний противовирусного препарата Ремдесивир, при этом первая группа пациентов с пневмонией, вызванной коронавирусом нового типа /2019-nCoV/, как ожидается, начнет принимать данный препарат 6 февраля. Об этом сообщили 5 февраля на специальной конференции.
Заявка была одобрена при поддержке Министерства науки и техники, Государственного комитета по делам здравоохранения и Государственного управления по надзору за лекарственными средствами КНР.
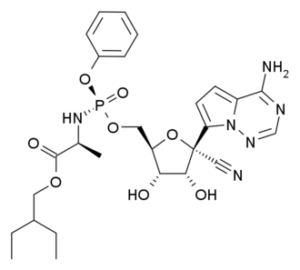
Ремдесивир является препаратом, разработанным американской фармацевтической компанией Gilead Sciences, заявил Цао Бинь, руководитель программы клинических испытаний препарата на конференции, прошедшей в больнице «Цзиньиньтань» города Ухань центральнокитайской провинции Хубэй под эгидой Министерства науки и техники страны.
Данный препарат продемонстрировал высокую противовирусную активность в отношении коронавирусов SARS и MERS в ходе предыдущих экспериментов на клетках и животных. Его клинические испытания на предмет эффективности в отношении заражения вирусом Эбола были проведены за рубежом. Согласно результатам соответствующих отечественных исследований, он также показал относительно высокую противовирусную активность против коронавируса 2019-nCoV на клеточном уровне, сказал Цао Бинь.
В общей сложности 761 пациент был включен в клинические испытания, которые будут проводиться по рандомизированным, двойным слепым и плацебо-контролируемым методам исследования.
Испытания, организованные Больницей китайско-японской дружбы и Институтом фармакологии Академии медицинских наук Китая, будут проведены в ряде больниц Уханя, в том числе в больнице «Цзиньиньтань».
На этот препарат возложена надежда, однако для подтверждения его реальной эффективности необходимо дождаться результатов клинических испытаний, заявил Ван Чэнь, замглавы Инженерной академии Китая и руководитель Академии медицинских наук Китая.
Источник: https://gmpnews.ru
7.02.2020