Bristol Myers Squibb и Janssen запускают лучшую в мире программу КИ фазы 3 для перорального ингибитора фактора XIa
Bristol Myers Squibb в сотрудничестве с Janssen Pharmaceuticals, Inc., входящей в состав Johnson and Johnson (Janssen), объявила о запуске фазы 3 Librexia в программе изучения Milvexian — исследуемого перорального ингибитора фактора XIa (FXIa) антитромботического действия. Программа Librexia является наиболее полной в мире программой клинической разработки фактора XIa в фазе 3 и предоставит необходимые данные о почти 50 000 пациентов в рамках трех одновременных клинических исследований (КИ), включая Librexia STROKE, Librexia ACS и Librexia AF.
Программа Librexia не имеет себе равных в мире, как наиболее комплексная программа разработки FXIa на сегодняшний день. На данный момент начат набор пациентов в исследование Librexia STROKE, где оценивается применение Milvexian в дополнение к стандартной антитромбоцитарной терапии для профилактики инсульта у пациентов после острого ишемического инсульта либо транзиторной ишемической атаки высокого риска. Также в первой половине 2023 года начнется КИ Librexia ACS, оценивающее снижение числа случаев острого коронарного синдрома в дополнение к стандартной антитромбоцитарной терапии, и КИе Librexia AF, изучающее эффективность Milvexian сравнительно с apixaban в профилактике инсульта у пациентов с фибрилляцией предсердий.
«Глубина и широта программы клинической разработки Librexia позволит собрать данные в трех взаимосвязанных, но различных областях клинических потребностей, связанных с остаточным риском тромботических событий и кровотечений, а также оценить потенциал Milvexian для продвижения за пределы текущего стандарта лечения и улучшения результатов терапии при острых коронарных синдромах, мерцательной аритмии и ишемическом инсульте», — сказал Роберт Харрингтон (Robert Harrington), руководитель программы Librexia, доктор медицины, и заведующий кафедрой медицины Стэнфордского университета.
Важные данные КИ фазы 2 проверки концепции Milvexian продемонстрировали дифференцированный антитромботический профиль как в монотерапии, так и в комбинации с антитромбоцитарной терапией. Сюда вошли данные о пациентах с ишемическим инсультом или транзиторной ишемической атакой высокого риска, которые могут предложить убедительный профиль пользы, что в конечном итоге позволило начать программу Librexia в этом году.

«Программа Librexia является первой в своем роде клинической программой, в которой одновременно реализуются сразу три КИ фазы 3, целью которых является изучение того, может ли Milvexian улучшить соотношение польза/риск при тромботической терапии за счет снижения тромботических событий с меньшим кровотечением у большего числа нуждающихся пациентов. BMS и Janssen привносят в эту программу богатое наследие и опыт в области лечения сердечно-сосудистых заболеваний в партнерстве с известными экспертами, и мы с нетерпением ожидаем продолжения оценки потенциала милвексиана для удовлетворения основных неудовлетворенных медицинских потребностей пациентов, живущих с тромботическими заболеваниями», — заявил Роланд Чен (Roland Chen), доктор медицины, старший вице-президент и руководитель отдела глобальной разработки лекарств для сердечно-сосудистой системы в Bristol Myers Squibb».
О Milvexian
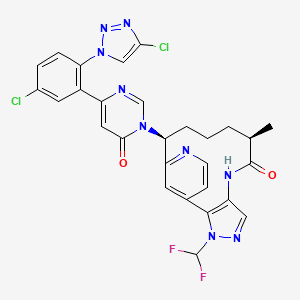
Milvexian представляет собой исследуемый пероральный ингибитор фактора XIa (FXIa) (антитромботический препарат), нацеленный и изучаемый для профилактики и лечения серьезных тромботических состояний в рамках программы Librexia, наиболее полной в мире программы КИ FXIa на сегодняшний день. Milvexian является экспериментальным препаратом и не был одобрен для использования ни в одной стране ни по какому показанию.
О программе Librexia
Программа Librexia является наиболее полной и непревзойденной программой клинической разработки FXIa на сегодняшний день, в ней участвуют почти 50 000 пациентов в рамках трех параллельных клинических испытаний (Librexia STROKE, Librexia ACS и Librexia AF). Опираясь на убедительные данные об эффективности и безопасности фазы 2, программа Librexia направлена на изучение того, может ли Milvexian улучшить соотношение польза/риск, связанное с лечением пациентов с этими тремя состояниями, за счет снижения тромботических событий без увеличения риска кровотечения.
О Librexia STROKE
Librexia STROKE — это рандомизированное двойное слепое плацебо-контролируемое исследование 3 фазы с параллельными группами, целью которого является демонстрация эффективности и безопасности Milvexian в дополнение к однократной или двойной антитромбоцитарной терапии для профилактики инсульта после острого ишемического инсульта или транзиторного инсульта высокого риска.

О Librexia ACS
Librexia ACS — это рандомизированное, двойное слепое, плацебо-контролируемое, управляемое событиями КИ, целью которого является демонстрация эффективности и безопасности Milvexian после недавно перенесенного острого коронарного синдрома.
О Librexia AF
Librexia AF — рандомизированное, двойное слепое, двойное фиктивное исследование с параллельными группами и активным контролем для оценки эффективности и безопасности Milvexian по сравнению с apixaban у участников с мерцательной аритмией.
Об AXIOMATIC-SSP и AXIOMATIC-TKR
Программа КИ Milvexian в фазе 2 состояла из двух исследований: AXIOMATIC-TKR – рандомизированное, открытое многоцентровое КИ с разным диапазоном доз в параллельных группах, где оценивалась эффективность и безопасность Milvexian по сравнению с подкожным enoxaparin у пациентов, подвергающихся плановому тотальному лечению – эндопротезирование коленного сустава (TKR).
AXIOMATIC-SSP – глобальное, рандомизированное, двойное слепое, плацебо-контролируемое КИ фазы 2 с диапазоном доз, в котором оценивалась эффективность и безопасность Milvexian для предотвращения нового симптоматического ишемического инсульта или нового скрытого инфаркта головного мозга у пациентов, получающих аспирин и клопидогрель после острого ишемического инсульта или транзиторной ишемической атаки (ТИА). Всего в оба исследования было включено 3608 пациентов.
Источник: https://pipelinereview.com/
3.03.2023