Enhertu от AstraZeneca и Daiichi Sankyo получает уже 7-е по счету одобрение FDA при раке груди
FDA предоставило Enhertu (trastuzumab deruxtecan) от AstraZeneca и Daiichi Sankyo расширение маркировки для лечения метастатического рака груди с низким и сверхнизким уровнем HER2. Это решение регулятора выводит Enhertu на более раннюю линию лечения (использование после одной неудачной эндокринной терапии).

В последнее время Агентство благосклонно к продуктам компаний: всего 11 дней назад AstraZeneca и Daiichi Sankyo получили одобрение FDA для препарата Datroway – второго конъюгата антитела с лекарственным препаратом (antibody-drug conjugate, ADC) для лечения рака.
Регулятор США одобрил Enhertu как первое лечение, направленное на HER2, для пациентов с метастатическим раком груди с низким или ультранизким уровнем HER2 после прогрессирования заболевания после одной или нескольких эндокринных терапий.
Помимо того, что Enhertu стал первым лечением для тех, чьи опухоли показывают более низкий уровень биомаркера белка HER2, одобрение перемещает препарат на ступеньку выше в линейке лечения пациентов с метастатическим раком молочной железы с ультранизким уровнем HER2. Теперь его можно использовать после одной или нескольких неудачных эндокринных терапий.
Одобрение основано на результатах исследования DESTINY-Breast06, в котором Enhertu показал снижение риска прогрессирования заболевания или смерти на 36% по сравнению с химиотерапией. Медиана выживаемости без прогрессирования составила 13,2 месяца для тех, кто принимал Enhertu, по сравнению с 8,1 для пациентов, проходящих химиотерапию. Из тех, кто принимал Enhertu, 63% имели полный или частичный ответ на лечение по сравнению с 34% в группе химиотерапии.
«Эндокринная терапия обычно используется при первоначальном лечении HR-положительного метастатического рака молочной железы, а после прогрессирования последующая химиотерапия связана с плохими результатами», — отметил в пресс-релизе Адитья Бардия (Aditya Bardia), доктор медицины, проводивший исследование в UCLA Health Jonsson Comprehensive Cancer Center. «Но теперь Enhertu предлагает потенциально новый стандарт лечения для пациентов с HR-положительным, HER2-низким или даже HER2-ультранизким метастатическим раком молочной железы после эндокринной терапии».

Комментируя последнее разрешение на препарат, Дейв Фредриксон, (Dave Fredrickson) исполнительный вице-президент подразделения онкологической гематологии, AZ, сказал: «Основываясь на предыдущих одобрениях Enhertu, которые изменили практику, это новое одобрение позволяет использовать этот важный препарат в более ранних условиях лечения и для более широкой популяции пациентов с метастатическим раком молочной железы, экспрессирующим HER2». Кен Келлер (Ken Keller), глобальный руководитель онкологического бизнеса, а также президент и главный исполнительный директор Daiichi Sankyo, добавил: «Enhertu продолжает пересматривать классификацию и лечение HR-положительного метастатического рака молочной железы с помощью важных новых данных по всему спектру экспрессии HER2».
Enhertu был впервые одобрен в 2019 году для пациентов с неоперабельным или метастатическим HER2-положительным раком молочной железы, которые уже потерпели неудачу как минимум с двумя другими методами лечения. Ранее в 2019 году AZ сделала ставку на Enhertu в размере $6,9 млрд, заплатив $1,35 млрд авансом за разработку и коммерциализацию лечения за пределами Японии. Компании заявили, что с одобрением во вторник AZ должна Daiichi $175 млн в качестве промежуточного платежа.
Enhertu достиг статуса блокбастера в 2022 году, а за первые 3 квартала 2024 года он заработал $2,7 млрд, что более, чем $1,8 млрд за первые 3 квартала 2023 года.
Ранее в этом месяце компании-партнеры получили одобрение FDA на Datroway для лечения HR-положительного, HER2-отрицательного рака груди у пациентов, которые ранее пробовали эндокринную терапию и химиотерапию. В сделке на $5 млрд, с $1 млрд, выплаченных авансом, AZ подписала контракт в качестве партнера для ADC, направленного на Trop2. Trop2 — это трансмембранный гликопротеин, кодируемый геном Tacstd2. Это внутриклеточный преобразователь кальциевого сигнала, который дифференциально экспрессируется во многих видах рака.
О Trastuzumab deruxtecan
Trastuzumab deruxtecan, продаваемый под торговой маркой Enhertu, представляет собой конъюгат антитела с лекарственным средством, состоящий из гуманизированного моноклонального антитела Trastuzumab (Herceptin), ковалентно связанного с ингибитором топоизомеразы I deruxtecan (производным exatecan). Он лицензирован для лечения рака молочной железы или аденокарциномы желудка или гастроэзофагеальной области. Trastuzumab связывается с рецептором эпидермального фактора роста 2 (HER2/neu) и блокирует сигнализацию через него при раке, рост которого зависит от него.
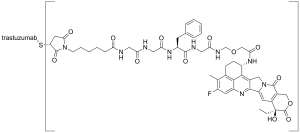
Кроме того, после связывания с рецепторами HER2 антитело усваивается клеткой, перенося с собой связанный deruxtecan, где оно препятствует способности клетки вносить структурные изменения в ДНК и реплицировать свою ДНК во время деления клетки. Такая вероятность приводит к повреждению ДНК, когда клетка пытается реплицировать себя, разрушая клетку.
Trastuzumab deruxtecan был одобрен для медицинского применения в Соединенных Штатах в декабре 2019 года, в Японии – в марте 2020 года, в ЕС – в январе 2021 года, и, в Австралии – в октябре 2021 года. Это первая одобренная FDA терапия, предназначенная для людей с подтипом рака молочной железы с низким уровнем HER2 и отрицательным уровнем HER2.
Источник: mailto:https://www.fiercepharma.com/
Источник: https://pmlive.com/
29.01.2025