FDA одобрило первый и единственный антагонист рецепторов эндотелина для лечения высокого кровяного давления
Биотехнологическая компания Idorsia Pharmaceuticals U.S. Inc. объявила, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило TRYVIO™ (aprocitentan) для лечения гипертензии в сочетании с другими антигипертензивными препаратами у взрослых пациентов. TRYVIO — это первая пероральная антигипертензивная терапия, которая работает по новому терапевтическому пути.

Снижение артериального давления уменьшает риск сердечно-сосудистых катастроф, в первую очередь, инсультов и инфарктов миокарда. Рекомендуемая доза TRYVIO составляет 12,5 мг перорально, 1 раз в день.
Во второй половине 2024 года Idorsia планирует сделать TRYVIO доступным для миллионов пациентов в США, состояние которых не контролируется другими препаратами.
Жан-Поль Клозель (Jean-Paul Clozel), генеральный директор Idorsia, прокомментировал: «Сегодня в стране живут миллионы американцев, чье кровяное давление не контролируется должным образом, несмотря на существующие методы лечения. Это серьезная проблема общественного здравоохранения, приводящая к высокой частоте сердечно-сосудистых и цереброваскулярных событий. Чтобы помочь радикально решить эту проблему, Idorsia разработала aprocitentan, уникальный антагонист рецепторов эндотелина, подходящий для лечения таких пациентов. Я горжусь командой Idorsia и очень рад, что у врачей появится принципиально новый вариант лечения пациентов, чье кровяное давление не контролируется».
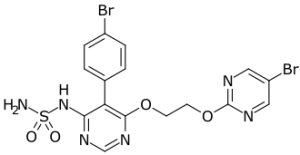
TRYVIO (aprocitentan) представляет собой антагонист рецепторов эндотелина, который ингибирует связывание эндотелина (ET)-1 с рецепторами ETА и ETВ. Эффекты ЕТ-1 имеют много общего с патофизиологией гипертонии, а ЕТ-1 – основной драйвер выработки альдостерона. До одобрения TRYVIO ни один системный антигипертензивный препарат не воздействовал на маршрут ET, поскольку одобренные антигипертензивные методы лечения фокусировались на регуляции уровня соли и воды (диуретики), системе антагонизма ренин-ангиотензин-альдостерона (РААС), снижении притока внеклеточного кальция в клетку (блокаторы кальциевых каналов), симпатолитической активности (бета-блокаторы, центральные альфа-агонисты) или неселективном общем сосудорасширяющем действии.
TRYVIO оценивался в качестве монотерапии в клиническом исследовании (КИ) фазы 2 у пациентов с гипертонией и в качестве дополнительной терапии – в КИ PRECISION фазы 3 у пациентов с подтвержденной резистентной гипертензией. В исследовании PRECISION aprocitentan хорошо переносился и превосходил плацебо в снижении артериального давления, начиная с 4-й недели, с устойчивым эффектом на 40-й неделе.
Таким образом, сначала препарат был протестирован отдельно в КИ фазы 2, а затем в качестве дополнения для пациентов с резистентной гипертонией в исследовании фазы 3. В конце концов, доза TRYVIO в 12,5 мг оказалась статистически значимой по сравнению с плацебо в снижении систолического артериального давления в положении сидя, по сравнению с исходными уровнями.
Эффект снижения давления в КИ при действии TRYVIO оказался постоянным среди всех многочисленных подгрупп исследованных пациентов, объединенных по самым разнообразным признакам (пол, возраст, наличие диабета, наличие других системных заболеваний и т.п.).
Что касается вывода продукта на рынок, компания «тщательно разработает» свою стратегию запуска TRYVIO в течение следующих нескольких месяцев, отметил президент и генеральный менеджер Idorsia U.S. Тош Батт (Tosh Butt). Idorsia планирует сделать препарат доступным во второй половине этого года.
Разработчик и производитель препарата, занимающийся исследованием эндотелина более трех десятилетий, отмечает «значительный медицинский прогресс», который представляет собой одобрение, добавила Мартина Клозель (Martine Clozel), главный научный сотрудник Idorsia. «Я убеждена, что с учетом полученных нами данных, одобрение TRYVIO знаменует новую эру наших исследований эндотелина, помимо гипертонии, поскольку теперь мы намерены изучить полезность aprocitentan для первого в своем классе применения при новых показаниях», — отметила эксперт.
В какой-то момент компания Johnson & Johnson также была уверена в препарате, что было продемонстрировано покупкой его фармацевтическим гигантом на сумму $230 млн в 2017 году. Было договорено, что после потенциального одобрения TRYVIO, гонорары будут идти Idorsia. В сентябре прошлого года фармгигант вернул препарат первоначальному производителю в рамках сделки на сумму до $343 млн. По условиям соглашения, J&J должен был иметь 30% от любых средств, полученных в результате отказа от лицензирования или продажи препарата, плюс 10% доходов от сделок с любыми продуктами Idorsia после одобрения TRYVIO.
Аналитики Jefferies в какой-то момент прогнозировали, что пиковые продажи aprocitentan составят примерно $2,5 млрд. Выручка Idorsia за первые 9 месяцев 2023 года составила $147 млн.
О компании Idorsia
Idorsia — швейцарская фармацевтическая исследовательская компания, расположенная в Альшвиле, Швейцария. После того, как Actelion была куплена Johnson & Johnson в 2017 году, Idorsia выделили в новую компанию и она начала работать в том же кампусе, где была основана Actelion, под руководством основателей Actelion Жан-Поля Клозеля (в качестве генерального директора) и Мартины Клозель.
В июле 2023 года плохих результатов продаж недавно одобренного снотворного препарата Daridorexant, в сочетании с неутешительными результатами КИ для Clazosentan и Lucerestat, Idorsia объявила об увольнениях до 500 сотрудников из работавших 1200, чтобы сократить денежные потери в своей штаб-квартире в Швейцарии на 50%. Основной акционер Жан-Поль Клозель предоставил Idorsia частный кредит в размере 75 миллионов швейцарских франков.
В том же месяце Idorsia продала свои действующие предприятия в Японии и Южной Корее японской фирме Sosei Heptares за 400 миллионов швейцарских франков. Это включает в себя права на продажу Сlazosentan (Piviaz) и Daridorexant (Quviviq) в Азиатско-Тихоокеанском регионе, за исключением Китая, а также права на два других метода лечения и до пяти программ клинической стадии, находящихся в разработке Idorsia.
Источник: https://www.prnewswire.com/
Источник: https://www.fiercepharma.com/
22.03.2024