FDA одобрило первый метод генной терапии для лечения пациентов с серповидноклеточной анемией
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило Casgevy (exagamglogene autotemcel) и Lyfgenia (lovotibeglogene autotemcel), представляющие собой первые методы клеточной генной терапии для лечения серповидно-клеточной анемии (sickle cell disease, SCD) у пациентов 12 лет и старше. Кроме того, Casgevy является первым одобренным FDA лечением, в котором используется новая технология редактирования генома, что свидетельствует о серьезном инновационном продвижении в области генной терапии.

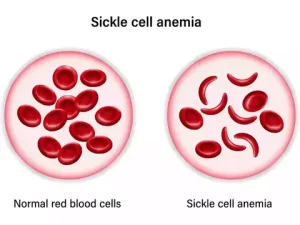
Серповидно-клеточная анемия — это группа наследственных заболеваний крови, от которых страдают примерно 100 000 человек в США. Она наиболее распространена у афроамериканцев, также поражает латиноамериканцев. Основной проблемой при серповидно-клеточной анемии является мутация гемоглобина — белка, содержащегося в эритроцитах, доставляющего кислород к тканям организма. Эта мутация приводит к тому, что эритроциты приобретают форму полумесяца или «серпа». Эти серповидные эритроциты ограничивают кровоток в кровеносных сосудах и ограничивают доставку кислорода к тканям организма, что приводит к сильной боли и повреждению органов, называемым вазоокклюзионными событиями (vaso-occlusive events, VOEs) или вазоокклюзионными кризами (vaso-occlusive crises, VOCs). Их повторение может привести к опасной для жизни инвалидности и/или ранней смерти.
«Серповидноклеточная анемия — это редкое, изнурительное и опасное для жизни заболевание крови, и мы рады продвинуться в этой области, одобрив сразу два метода клеточной генной терапии», — сказала Николь Верден (Nicole Verdun), доктор медицины, директор Управления терапевтических продуктов Центра оценки и исследования биологических препаратов FDA (Office of Therapeutic Products within the FDA’s Center for Biologics Evaluation and Research). «Генная терапия обещает обеспечить более целенаправленное и эффективное лечение, особенно для людей с редкими заболеваниями, для которых текущие возможности лечения ограничены».
Casgevy, клеточная генная терапия, одобрена для лечения серповидноклеточной анемии у пациентов в возрасте 12 лет и старше с рецидивирующими вазоокклюзионными кризами. Casgevy — первая одобренная FDA терапия, использующая CRISPR/Cas9, тип технологии редактирования генома. Гемопоэтические (кровяные) стволовые клетки пациентов модифицируются путем редактирования генома с использованием технологии CRISPR/Cas9.

CRISPR/Cas9 можно сфокусировать на разрезании ДНК в целевых областях, что дает возможность точно редактировать (удалять, добавлять или заменять) ДНК там, где она была разрезана. Модифицированные стволовые клетки крови трансплантируются обратно пациенту, где они прикрепляются (прикрепляются и размножаются) в костном мозге и увеличивают выработку фетального гемоглобина (HbF), типа гемоглобина, облегчающего доставку кислорода. У пациентов с серповидноклеточной анемией повышенный уровень HbF предотвращает серповидное образование эритроцитов.
Lyfgenia — это клеточная генная терапия. Lyfgenia использует лентивирусный вектор (носитель доставки генов) для генетической модификации и одобрен для лечения пациентов в возрасте 12 лет и старше с серповидно-клеточной анемией и вазоокклюзионными явлениями в анамнезе. При использовании Lyfgenia стволовые клетки крови пациента генетически модифицируются для производства HbAT87Q, гемоглобина, полученного генной терапией, функционирующего аналогично гемоглобину А, который является нормальным гемоглобином взрослого человека, вырабатываемым у людей, не страдающих серповидноклеточной анемией. Эритроциты, содержащие HbAT87Q, имеют меньший риск серповидности и закупорки кровотока. Эти модифицированные стволовые клетки затем доставляются пациенту.
Оба продукта производятся из собственных стволовых клеток крови пациентов, которые модифицируются и вводятся обратно в виде однократной инфузии одной дозы в рамках трансплантации гемопоэтических (кровяных) стволовых клеток. Перед лечением у пациента собираются собственные стволовые клетки, а затем пациент должен пройти миелоаблативное кондиционирование (высокодозную химиотерапию) – процесс, при котором клетки костного мозга удаляются, чтобы их можно было заменить модифицированными клетками при Casgevy и Lyfgenia. Пациенты, получавшие Casgevy или Lyfgenia, будут находиться под наблюдением в долгосрочном исследовании для оценки безопасности и эффективности каждого продукта.

Данные в поддержку Casgevy (exagamglogene autotemcel)
Безопасность и эффективность Casgevy оценивались в продолжающемся одногрупповом многоцентровом исследовании у взрослых и подростков с ВСС. У пациентов в анамнезе было по крайней мере два тяжелых VOC, определенных протоколом, в течение каждого из двух лет до скрининга. Первичным результатом эффективности было отсутствие тяжелых эпизодов VOC в течение как минимум 12 месяцев подряд в течение 24-месячного периода наблюдения. Всего препаратом Casgevy лечились 44 пациента. Из 31 пациента, у которых было достаточно времени для оценки, 29 (93,5%) достигли этого результата. У всех пролеченных пациентов было достигнуто успешное приживление трансплантата, при этом ни у одного пациента не наблюдалось отторжение трансплантата.
Наиболее распространенными побочными эффектами были низкий уровень тромбоцитов и лейкоцитов, язвы во рту, тошнота, скелетно-мышечная боль, боль в животе, рвота, фебрильная нейтропения (лихорадка и низкое количество лейкоцитов), головная боль и зуд.
Данные в поддержку Lyfgenia (lovotibeglogene autotemcel)
Безопасность и эффективность Lyfgenia основана на анализе данных одногруппового 24-месячного многоцентрового исследования у пациентов с серповидно-клеточной анемией и VOE в анамнезе в возрасте от 12 до 50 лет. Эффективность оценивали на основе полного разрешения VOE (VOE-CR) через 6–18 месяцев после инфузии Lyfgenia. Двадцать восемь (88%) из 32 пациентов достигли VOE-CR за этот период времени.
Наиболее распространенные побочные эффекты включали стоматит (язвы на губах, во рту и горле), низкий уровень тромбоцитов, лейкоцитов и эритроцитов, а также фебрильную нейтропению (лихорадка и низкое количество лейкоцитов).
У пациентов, получавших Lyfgenia, наблюдались гематологические злокачественные новообразования (рак крови). На этикетке препарата Лифгения содержится предупреждение «черный ящик» с информацией об этом риске. Пациенты, получающие этот продукт, должны находиться под пожизненным наблюдением за этими злокачественными новообразованиями.
Заявки Casgevy и Lyfgenia получили статусы Priority Review, Orphan Drug, Fast Track and Regenerative Medicine Advanced Therapy designations.
FDA предоставило одобрение Casgevy компании Vertex Pharmaceuticals Inc. и одобрение Lyfgenia компании Bluebird Bio Inc.
О Vertex Pharmaceuticals Inc.
Vertex Pharmaceuticals — глобальная биотехнологическая компания, инвестирующая в научные инновации для создания преобразующих лекарств для людей с серьезными и опасными для жизни заболеваниями. Корпоративная штаб-квартира компании была основана в 1989 году в Кембридже, штат Массачусетс, сейчас находится в Инновационном районе Бостона, а международная штаб-квартира расположена в Лондоне, Великобритания. В настоящее время в Vertex работает около 3500 человек в США, Европе, Канаде, Австралии и Латинской Америке, причем почти 75% персонала занимаются исследованиями и разработками. Исследовательские центры расположены в Сан-Диего, Калифорния, и Милтон-Парке, Оксфордшир, Англия.
Vertex неизменно признается одним из лучших мест для работы в отрасли по версии журналов Science Magazine, The Boston Globe, Boston Business Journal и San Diego Business Journal. Ее исследования и лекарства также получили почетные признания, в том числе премию Роберта Дж. Билла за развитие терапии, французскую премию Галиена и награды Британского фармакологического общества. Это одна из первых биотехнологических фирм, которая использовала явную стратегию рационального дизайна лекарств, а не комбинаторную химию.
О Bluebird Bio Inc.
Bluebird Bio, Inc., базирующаяся в Сомервилле, штат Массачусетс, является биотехнологической компанией, которая разрабатывает генную терапию для тяжелых генетических нарушений. Единственным одобренным препаратом компании в Европейском Союзе (ЕС) является betibeglogene autotemcel (Zynteglo), лечащий трансфузионно-зависимую бета-талассемию, редкое генетическое заболевание крови, одобренный для использования Европейским агентством по лекарственным средствам. Компанию критиковали за стоимость препарата в $1,8 млн, он является вторым самым дорогим препаратом в мире.
Компания занимается разработкой генной терапии LentiGlobin для лечения серповидноклеточной анемии и церебральной адренолейкодистрофии. Компания также разрабатывает кандидатные продукты Т-клеток для лечения острого миелолейкоза, карциномы Меркеля, диффузной крупноклеточной В-клеточной лимфомы и солидных опухолей MAGEA4.
Источник: https://www.fda.gov/
11.12.2023