FDA одобрило препарат Merck для лечения распространенной почечно-клеточной карциномы
Это решение регулятора знаменует собой первое с 2015 года одобрение нового метода лечения распространенного почечно-клеточного рака (renal cell carcinoma, RCC). WELIREG® (belzutifan) – первый и единственный ингибитор индуцируемого гипоксией фактора-2 альфа (HIF-2α), одобренный для лечения взрослых пациентов с распространенным RCC.

Компания Merck, известная как MSD за пределами США и Канады, объявила, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило WELIREG® (belzutifan), пероральный препарат, индуцирующий гипоксию. Это ингибитор фактора-2 альфа (HIF-2α) для лечения взрослых пациентов с RCC после применения ингибитора рецептора программируемой смерти-1 (programmed death receptor 1, PD-1) или лиганда программируемой смерти 1 (programmed death ligand 1, PD-L1) и ингибитора тирозинкиназы фактора роста эндотелия сосудов (vascular endothelial growth factor tyrosine kinase inhibitor, VEGF-TKI).
Одобрение основано на статистически и клинически значимых результатах клинического исследования (КИ) LITESPARK-005, являющегося единственным исследованием распространенной RCC, специально оценивающего пациентов, у которых наблюдается прогрессирование после приема ингибитора PD-1 или PD-L1 и VEGF-TKI. В КИ WELIREG продемонстрировал превосходную выживаемость без прогрессирования (progression-free survival, PFS) (HR=0,75 [95% ДИ, 0,63-0,90]; p=0,0008) по сравнению с everolimus, при распространенном RCC, после лечения с контрольной точкой PD-1 или PD-L1 и VEGF. Кроме того, WELIREG показал частоту объективного ответа (objective response rate, ORR) 22% (n=82) (95% ДИ, 18-27) по сравнению с 4% (n=13) (95% ДИ, 2-6) для everolimus.
«Несмотря на недавний прогресс в лечении распространенного RCC, еще не существует варианта, специально одобренного для пациентов, у которых заболевание прогрессирует после применения ингибитора PD-1 или PD-L1 и терапии TKI», — заявил руководитель исследования LITESPARK-005, доктор Тони К. Шуейри (Toni K. Choueiri), директор Центра онкологии мочеполовой системы Ланк (Lank Center for Genitourinary Oncology) в Институте рака Дана-Фарбер (Dana-Farber Cancer Institute) и профессор медицины Гарвардской медицинской школы (Harvard Medical School). «Это одобрение belzutifan открывает новый значимый вариант лечения для некоторых пациентов, поскольку препарат снижает риск прогрессирования заболевания или смерти сравнительно с everolimus».
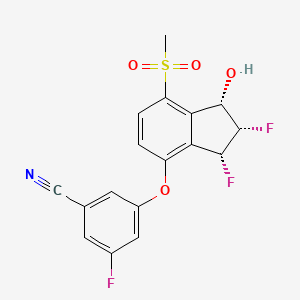
На этикетке WELIREG содержится предупреждение в рамке о том, что его применение во время беременности может нанести вред плоду. Препарат также может снижать эффективность некоторых гормональных контрацептивов.
WELIREG способен вызвать тяжелую анемию, которая может потребовать переливания крови. Он также способен вызвать тяжелую гипоксию, требующую прекращение приема лекарства, использование дополнительного кислорода либо госпитализации.
«В 2021 году WELIREG, как ингибитор HIF-2α, стал первой терапией, одобренной в США для лечения взрослых пациентов с некоторыми опухолями, связанными с заболеванием VHL, и вот теперь он одобрен для подходящих пациентов с распространенным RCC», — сказала доктор Марджори Грин (Marjorie Green), старший вице-президент и руководитель отдела поздних стадий онкологии и глобальных клинических разработок исследовательских лабораторий Merck. «Это одобрение WELIREG знаменует собой первый почти за 10 лет новый терапевтический класс, доступный для подходящих пациентов с распространенным RCC, и основано на статистически значимом преимуществе выживаемости без прогрессирования, наблюдаемом у пациентов после лечения ингибитором PD-1 или PD-L1 и VEGF-TKI сравнительно с everolimus».
Дизайн исследования и дополнительные данные, подтверждающие одобрение регулятором
Одобрение было основано на данных LITESPARK-005, открытого рандомизированного КИ с активным контролем (ClinicalTrials.gov, NCT04195750) у 746 пациентов с неоперабельным, местно-распространенным или метастатическим светлоклеточным RCC, прогрессировавшим после PD-1 или PD-L1 и терапии, нацеленной на рецептор VEGF, последовательно или в комбинации. Пациенты могли ранее получить до трех схем лечения и должны были иметь измеримое заболевание согласно RECIST v1.1. Пациенты были рандомизированы 1:1 для приема WELIREG (120 мг) (n=374) или everolimus (10 мг) (n=372) перорально 1 раз в день. Рандомизация была стратифицирована по категориям риска Международного консорциума баз данных метастатического RCC (IMDC) (благоприятный, средний или плохой) и количеству предшествующих курсов таргетной терапии, направленной на рецептор VEGF (1 против 2-3). Рентгенологическое обследование пациентов проводилось на 9-й неделе с момента рандомизации, затем каждые 8 недель до 49-й недели, и далее, каждые 12 недель.

Основными конечными точками эффективности были PFS по оценке слепого независимого центрального обзора (blinded independent central review, BICR) в соответствии с RECIST v1.1 и общая выживаемость. Дополнительные конечные точки эффективности включали ORR по оценке BICR в соответствии с RECIST v1.1.
Исследование продемонстрировало статистически значимое улучшение PFS у пациентов, рандомизированных в группу WELIREG, по сравнению с группой everolimus.
Среди 82 пациентов, получавших WELIREG и достигших подтвержденного ответа на основании BICR по RECIST 1.1, у 25 (30%) пациентов продолжительность ответа составила ≥12 месяцев. Общие результаты выживаемости были незрелыми. На момент последующего предварительного анализа в рандомизированной популяции умерло 59% пациентов.
В исследовании WELIREG снижал риск прогрессирования заболевания или смерти на 25% (ОР=0,75 [95% ДИ, 0,63-0,90]; p=0,0008) по сравнению с everolimus у этих пациентов. Медиана ВБП составила 5,6 месяца (95% ДИ, 3,9–7,0) для WELIREG по сравнению с 5,6 месяца (95% ДИ, 4,8–5,8) для everolimus. ORR для WELIREG составило 22% (n=82) (95% ДИ, 18-27), с частотой полного ответа (CR) 3% (n=10) и частотой частичного ответа (PR) 19% ( n=72), а ORR для эверолимуса составила 4% (n=13) (95% ДИ, 2-6), при этом ни у одного пациента не было достигнуто полное выздоровление и показатель PR 4% (n=13).
Побочные реакции
Средняя продолжительность воздействия WELIREG составила 7,6 месяцев (диапазон от 0,1 до 28,5 месяцев). Серьезные побочные реакции возникли у 38% пациентов, получавших WELIREG. Серьезными побочными реакциями у ≥2% пациентов, получавших WELIREG, были гипоксия (7%), анемия (5%), пневмония (3,5%), кровотечение (3%) и плевральный выпот (2,2%). Фатальные побочные реакции наблюдались у 3,2% пациентов, получавших WELIREG, включая сепсис и кровотечения (по 0,5%).
Постоянное прекращение приема WELIREG из-за побочных реакций произошло у 6% пациентов. Побочными реакциями, которые привели к окончательному прекращению приема WELIREG а (≥0,5%), были гипоксия (1,1%), анемия и кровотечение (по 0,5%). Прерывание приема препарата из-за побочных реакций произошло у 39% пациентов, побочными реакциями, потребовавшими прекращения приема препарата у ≥2% пациентов, были анемия (8%), гипоксия (5%), COVID-19 (4,3%), утомляемость (3,2%) и кровотечение (2,2%). Снижение дозы WELIREG из-за побочных реакций произошло у 13% пациентов. Побочными реакциями, потребовавшими снижения дозы у ≥1% пациентов, были гипоксия (5%) и анемия (3,2%). Наиболее частыми (≥25%) побочными реакциями, включая отклонения лабораторных показателей, возникавшими у пациентов, получавших WELIREG, были снижение гемоглобина, утомляемость, скелетно-мышечная боль, повышение креатинина, снижение количества лимфоцитов, повышение уровня аланинаминотрансферазы, снижение натрия, повышение калия. Клинически значимые побочные реакции у <10% пациентов, получавших WELIREG в LITESPARK-005, включали кровоизлияние (9%) [в том числе внутричерепное/церебральное кровоизлияние (0,8%)), сыпь (8%), артериальную гипертензию (6%), нарушения зрения [ в том числе нечеткость зрения (4%), снижение остроты зрения (1,1%), нарушение зрения (0,5%) и отслоение сетчатки (0,3%)] (6%) и увеличение веса (5%).
О почечно-клеточном раке (RCC)
Почечно-клеточная карцинома на сегодняшний день является наиболее распространенным типом рака почки; около 9 из 10 диагнозов рака почки являются RCC. Почечно-клеточный рак встречается примерно в 2 раза чаще у мужчин, чем у женщин. Большинство случаев RCC обнаруживаются случайно во время визуализирующих исследований при других заболеваниях брюшной полости. Примерно у 15% пациентов рак почки диагностируется на поздней стадии.
Источник: https://pipelinereview.com/
Источник: https://www.merckclinicaltrials.com/
19.12.2023