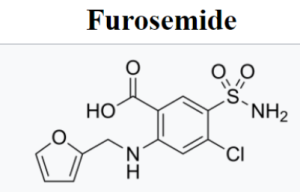
FDA одобрило расширение показаний для инъекций Furosemide для лечения отеков у пациентов с хронической болезнью почек
FDA одобрило расширенное показание для инъекций Furosemide (Furoscix; scPharmaceuticals, Inc.), включающее лечение отеков у взрослых пациентов с хронической болезнью почек (ХБП), включая нефротический синдром. Ожидается, что расширенная терапия будет доступна к апрелю 2025 года.

Инъекции Furosemide в настоящее время одобрены для подкожного применения в дозах 80 мг/10 мл для лечения застоя, связанного с перегрузкой жидкостью, у взрослых пациентов с сердечной недостаточностью 2-го и 3-го классов по классификации Нью-Йоркской кардиологической ассоциации (NYHA). С этим показанием инъекция стала первым и единственным одобренным FDA подкожным петлевым диуретиком, который позволяет осуществлять внутривенный (IV) эквивалентный диурезу в домашних условиях с помощью инфузионного аппарата Furoscix On-Body.
Эквивалентность IV была продемонстрирована в клиническом исследовании, в котором инъекция Furosemide продемонстрировала биодоступность около 99,6% (90% ДИ: 94,8% -104,8%) и 8-часовой диурез 2,7 л, что было аналогично пациентам, получавшим Furosemide внутривенно.
«Потенциальное расширение показаний инъекции Furosemide с включением ХБП может поддержать ключевую долгосрочную инициативу роста и возможность улучшить жизнь пациентов с ХБП, поскольку заболевание поражает более 1 из каждых 7 взрослых в США и характеризуется частыми эпизодами перегрузки жидкостью», — сказал Джон Такер (John Tucker), генеральный директор scPharmaceuticals.
В апреле 2024 года было объявлено, что первый участник был включен в основное фармакокинетическое исследование Furosemide 80 мг/мл (SCP-111), исследуемой, малообъемной, pH-нейтральной формулы препарата, вводимой через автоинъектор. Автоинъектор разрабатывается как дополнение к одобренному FDA On-body Infusor в попытке предоставить пациентам подкожную инъекцию и врачам гибкость лечения. В это время Такер также отметил в пресс-релизе продвижение 2 потенциальных инициатив по расширению маркировки с On-Body Infusor: сердечная недостаточность 4 класса по NYHA, которая составляет около 10% пациентов с сердечной недостаточностью; и ХБП.
«Разработка формулы Furosemide в малых объемах, которую можно вводить подкожно с помощью автоинъектора, является потенциальным долгосрочным драйвером роста для нас, и мы очень рады, что теперь зарегистрировали первого участника в этом исследовании», — сказал Такер. «Мы ожидаем, что это будет эффективное исследование, и с нетерпением ждем основных данных в третьем квартале, которые, как мы считаем, в случае успеха позволят нам подать sNDA в FDA к концу года».
О компании scPharmaceuticals, Inc.
Миссия scPharmaceuticals, Inc.направлена на развитие кардиоренальной помощи с помощью инновационных, комплексных методов лечения, которые удовлетворяют неудовлетворенные потребности пациентов.
Цель компании — стать главным сторонником кардиоренальной помощи, ориентированной на пациента, способствуя улучшению здоровья во всем мире с помощью специализированных, многопрофильных подходов. scPharmaceuticals расширяет свое присутствие, предлагая комплексные методы лечения и продукты, которые удовлетворяют различные потребности здравоохранения и потенциально улучшают жизнь пациентов.
Штаб-квартира созданной в 2013 году scPharmaceuticals находится в Берлингтоне, штат Массачусетс.
Источник: https://www.pharmacytimes.com/
Источник: https://www.globenewswire.com/
11.03.2025