FDA сняло запрет на клинические испытания препарата компании Neurizon для лечения бокового амиотрофического склероза
Американский регулятор снял запрет на клинические испытания препарата NUZ‑001 (ранее известного, как Zolvix, Monepantel) австралийской биотехнологической компании Neurizon Therapeutics, что открывает путь для его перехода к исследованию HEALEY-ALS. Разработка ведущего препарата компании для лечения бокового амиотрофического склероза (БАС) была приостановлена в феврале 2025 года.

Решение FDA открывает Neurizon возможность для исследования препарата в рамках исследования HEALEY-ALS II/III фазы. Тем не менее, компания готовится подать поправку к протоколу заявки на новый исследуемый препарат (investigational new drug, IND) для исследования, которое должно начаться в четвертом квартале 2024 года. Платформа HEALEY «ускоряет исследования БАС», изучая сразу несколько препаратов. В испытании принимали участие такие препараты, как Zilbrysq (zilucoplan), verdiperstat, CNM-Au8, и pridopidin.
Генеральный директор компании Neurizon, доктор Майкл Турн (Michael Thurn), заявил: «Одобрение FDA нашей заявки на регистрацию IND знаменует собой важную веху в нашей миссии по обеспечению доступности NUZ-001 для пациентов с БАС.
Сейчас мы сотрудничаем с командой HEALEY, проводящей испытания платформы для БАС, чтобы сделать следующие важные шаги в развитии NUZ-001. Подтвержденные нашими убедительными доклиническими данными TDP-43 и обнадеживающими результатами выживаемости, полученными в ходе открытого расширенного исследования (OLE) у пациентов с БАС, мы считаем, что NUZ-001 может значительно замедлить прогрессирование этого разрушительного заболевания», — добавил Турн.
В исследовании OLE (NCT06177431), в котором участвовали пациенты из исследования MEND I фазы (NCT04894240), предполагаемая средняя скорость снижения составила -0,88 балла в месяц по пересмотренной шкале функциональной оценки БАС (ALSFRS-R) по сравнению с -0,74 балла в месяц, наблюдавшимися в исследовании MEND, что свидетельствует о стабильном и длительном лечении.
Статистически значимой разницы в проценте прогнозируемой жизненной емкости легких (ЖЕЛ) от начала исследования MEND до конца исследования OLE не наблюдалось. Средний ЖЕЛ снизился с 84,40% в начале MEND до 62,33% после Исследование OLE.

Рынок БАС готовится к расширению
В сентябре 2025 года моноклональное антитело (мАТ) компании AL-S Pharma достигло своих первичных конечных точек в исследовании II фазы. В рандомизированном двойном слепом плацебо-контролируемом исследовании (NCT05039099) AP-101 в сочетании со стандартной терапией (SoC) достиг конечных точек безопасности и переносимости у пациентов со спорадическим БАС и мутантным SOD1-БАС; однако AL-S Pharma пока не предоставлены конкретные данные.
GlobalData прогнозирует, что продажи лекарственных средств для БАС достигнут $1,28 млрд к 2029 году по сравнению с $317 млн в 2019 году, при этом рост будет в основном обусловлен появлением 12 новых препаратов, находящихся в разработке.
О боковом амиотрофическом склерозе (БАС)
БАС — это разрушительное нейродегенеративное заболевание, поражающее преимущественно нервные клетки, отвечающие за произвольные движения мышц. Оно характеризуется тяжёлыми изнуряющими симптомами, включая мышечную слабость, атрофию и паралич. Ограниченные варианты лечения позволяют лишь облегчить симптомы, но не обратить вспять прогрессирование заболевания. Статистика БАС: заболеваемость составляет примерно 5-7 случаев на 100 000 населения в мире, а в России насчитывается около 12-15 тысяч заболевших. Заболевание чаще развивается у мужчин, чем у женщин, и обычно проявляется после 40 лет. Лишь 5-10% случаев БАС связаны с наследственностью, тогда как подавляющее большинство случаев (90-95%) имеют спорадический (неизвестного происхождения) характер.
О препарате NUZ-001
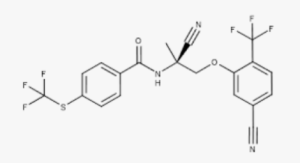
NUZ-001 — это пероральный дегельминтизирующий препарат, используемый в ветеринарии. Он ингибирует mTOR, предотвращая фосфорилирование 4EBP1. Компания Neurizon надеется, что он окажет терапевтическое воздействие при БАС у людей. NUZ-001 — ингибитор mTOR, который исследуется для лечения нейродегенеративных заболеваний, в частности бокового амиотрофического склероза (БАС). Препарат действует путем активации аутофагии, снижения агрегации TDP-43 и восстановления экспрессии STMN2, демонстрируя многообещающие результаты доклинических исследований и исследований фазы I для замедления прогрессирования заболевания и сохранения двигательной функции. Препарат, ранее известный как monepantel, также изучается при других заболеваниях, таких как болезнь Альцгеймера и болезнь Паркинсона.
О компании Neurizon Therapeutics
Созданная в 2000 году Neurizon Therapeutics Limited, ранее известная как PharmAust, — биотехнологическая компания, находящаяся на стадии клинических исследований и занимающаяся разработкой новых методов лечения нейродегенеративных заболеваний. Neurizon разрабатывает свой ведущий препарат-кандидат NUZ-001 для лечения бокового амиотрофического склероза (БАС), наиболее распространённой формы заболевания двигательных нейронов. Стратегия Neurizon заключается в ускорении доступа пациентов к эффективным методам лечения БАС, одновременно исследуя потенциал NUZ-001 для более широкого применения в нейродегенеративной сфере. Благодаря международному сотрудничеству и активным клиническим программам Neurizon стремится открыть новые горизонты для пациентов и их семей, страдающих от сложных неврологических заболеваний. Штаб-квартира компании расположена в Мельбурне, Австралия.
Источник: https://www.clinicaltrialsarena.com/
Источник: https://medicaldialogues.in/
Источник: https://www.neurizon.com/
8.10.2025