FDA США одобрило терапию синдрома Ретта от Acadia Pharmaceuticals
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило препарат Daybue (trofinetide) американской биофармацевтической компании Acadia Pharmaceuticals для лечения синдрома Ретта (Rett syndrome) у взрослых и детей в возрасте от двух лет и старше. Одобрение Daybue было подтверждено данными, полученными в ходе базового исследования LAVENDER III фазы.

Daybue является первым и единственным препаратом, получившим одобрение для лечения синдрома Ретта, сложного редкого нарушения развития нервной системы, которым страдают от 6000 до 9000 пациентов в США. Попытки получить препарат, способный лечить заболевание длились около 40 лет.
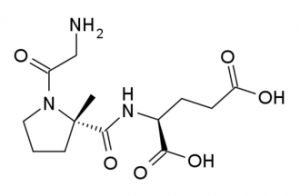
Trofinetide представляет собой синтетическую версию встречающейся в природе молекулы трипептида глицина-пролина-глутамата (tripeptide glycine-proline-glutamate, GPE). Механизм, с помощью которого trofinetide оказывает терапевтическое действие на пациентов с синдромом Ретта, неизвестен. В исследованиях на животных было показано, что трофинетид увеличивает разветвление дендритов и сигналы синаптической пластичности.
Генеральный директор Acadia Pharmaceuticals Стив Дэвис (Steve Davis) в интервью заявил: «Сегодняшний день знаменует собой важную веху для сообщества Rett и Acadia. Как первый одобренный FDA препарат для лечения синдрома Ретта, Daybue теперь дает возможность существенно изменить жизнь пациентов и их семей, у которых не было вариантов лечения изнурительных симптомов, вызванных синдромом Ретта. Мы благодарны всем пациентам с синдромом Ретта, лицам, осуществляющим уход, клиническим исследователям и нашим сотрудникам, внесшим свой вклад в то, чтобы сделать сегодняшний день реальностью, и надеемся, что Daybue будет доступен пациентам как можно скорее».
«Мы благодарны за инвестиции, сделанные Acadia, чтобы провести это первое лечение через фазу 3 и получить одобрение FDA. Мы благодарны всем нашим партнерам — врачам, исследователям, ученым, нашему Cовету директоров и донорам, которые внесли свой вклад в разработку trofinetide. Мы особенно благодарны людям, которые участвовали в процессе КИ trofinetide. Именно благодаря их храбрости сообщество людей с синдромом Ретта может отпраздновать эту веху. 40 лет назад никто не инвестировал в исследования синдрома Ретта. Теперь все изменилось, и мы готовы к новым прорывам, подобным этому. В 2023 году начнутся многочисленные КИ генной терапии, более 20 компаний инвестируют в лечение, и существует более 40 активных исследовательских проектов, расширяющих наши знания о том, что вызывает синдром Ретта», – сказала Мелисса Кеннеди (Melissa Kennedy), главный исполнительный директор IRSF (Internation Rett Syndrome Foundation)
Утверждение регулирующих органов было подтверждено данными, полученными в ходе основного исследования III фазы LAVENDER. Исследование разработано для оценки безопасности и эффективности trofinetide по сравнению с плацебо у 187 женщин с синдромом Ретта в возрасте от 5 до 20 лет.
Согласно полученным данным, у участников, принимавших Daybue, наблюдалось статистически значимое улучшение обеих первичных конечных точек эффективности. Они измеряются изменением общего балла поведенческого опросника синдрома Ретта (RSBQ) и балла по шкале общего клинического впечатления-улучшения (CGI-I) по сравнению с исходным уровнем на 12-й неделе.
Рвота и диарея являются наиболее распространенными побочными эффектами, наблюдаемыми в ходе КИ.

О синдроме Ретта
Синдром Ретта — редкое генетическое неврологическое заболевание, которое встречается почти исключительно у девочек, реже у мальчиков и приводит к тяжелым нарушениям, затрагивающим почти все аспекты жизни ребенка: способность говорить, ходить, есть и даже дышать. Отличительной чертой синдрома Ретта являются почти постоянные повторяющиеся движения рук. Синдром Ретта обычно распознают у детей в возрасте от 6 до 18 месяцев, когда они начинают пропускать этапы развития или теряют приобретенные навыки.
Синдром Ретта вызывается мутациями на Х-хромосоме гена MECP2. В гене MECP2 обнаружено более 900 различных мутаций, большинство из которых обнаружено в восьми различных «горячих точках». Синдром Ретта не является дегенеративным заболеванием у людей, доживших до среднего возраста или старше. Синдром Ретта встречается во всем мире у 1 из каждых 10 000 новорожденных девочек и еще реже у мальчиков. Синдром Ретта может приводить к инвалидности различной степени. Течение и тяжесть синдрома Ретта определяются локализацией, типом и тяжестью мутации и Х-инактивации.
Acadia Pharmaceuticals Inc.
Acadia Pharmaceuticals Inc. — биофармацевтическая компания со штаб-квартирой в Сорренто Вэллей, Сан-Диего, Калифорния, известная своими достижениями. Так, Nuplazid, препарат, открытый и созданный Acadia в конце 1990-х годов, был разработан для стимуляции подмножества рецепторов серотонина мозга или белков, которые управляют памятью, познанием и обучением.
29 апреля 2016 года FDA одобрило препарат Acadia Nuplazid для лечения галлюцинаций и бреда, связанных с психозом при болезни Паркинсона. Nuplazid — торговое название запатентованной молекулы Acadia, pimavanserin — селективного обратного агониста серотонина, преимущественно нацеленного на рецепторы 5-HT2a.
Источник: https://www.pharmaceutical-technology.com/
Источник: https://www.rettsyndrome.org/
Источник: https://acadia.com/
14.03.2023