Glenmark Pharma публикует промежуточные данные исследования PMS по фавипиравиру
Glenmark Pharmaceuticals, глобальная фармацевтическая компания, объявила промежуточные данные о 503 пациентах из своего исследования постмаркетингового надзора по препарату фавипиравир в Индии. Данное исследование по надзору, начатое в июле 2020 года, сфокусировано на оценку безопасности и эффективности фавипиравира у пациентов с COVID-19 легкой и средней степени тяжести.

Это – первое крупное постмаркетинговое исследование фавипиравира у пациентов с COVID-19 от легкой до умеренной степени тяжести, проводимое в Индии, и по данным на сегодня в открытое многоцентровое исследование с одной группой было включено в общей сложности 1083 пациента.
В нем приняли участие 13 объектов — как государственных, так и частных — в Мумбаи, Бангалоре, Хайдарабаде, Нашике, Нагпуре и Тривандруме.
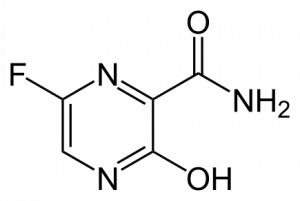
Предварительные данные, представленные Glenmark регулирующему органу, не выявили новых сигналов либо опасений по поводу безопасности при использовании фавипиравира, кроме уже хорошо известных побочных эффектов, таких как слабость, гастрит, диарея, рвота и т.д., которые оцениваются как легкие по своей природе. Исчезновение лихорадки наблюдалось на 3-й день, а две трети пациентов достигли клинического излечения на 7-й день.
Исследование проводилось среди пациентов с COVID-19 легкой и средней степени тяжести, в соответствии с утвержденными показаниями к применению препарата. Средний возраст пациентов составлял 40 лет, наиболее распространенная возрастная группа – 30-45 лет, где женщин – 40%, а мужчин – 60%. Гипертония и диабет являлись двумя наиболее частыми сопутствующими заболеваниями изученных пациентов. Исходно, у всех пациентов присутствовала лихорадка, сопровождающаяся кашлем (84,6%), утомляемостью (55%), потерей вкуса (38,1%).

«Отрадно отметить, что наши промежуточные данные подтверждают безопасность и эффективность FabiFlu® в реальных условиях. С момента своего запуска в прошлом году FabiFlu® принес огромное облегчение миллионам пациентов в Индии и во всем мире, а также существенно снизил общую нагрузку на инфраструктуру здравоохранения. В ближайшее время мы представим окончательные результаты исследования регулятору и продолжим информировать пациентов во всем мире о многочисленных преимуществах FabiFlu®», — комментирует полученные результаты Алок Малик (Alok Malik), вице-президент и руководитель группы компаний India Formulations.
19 июня 2020 года Glenmark стала первой компанией в Индии, получившей одобрение регулирующего органа страны по лекарственным средствам на ограниченное использование FabiFlu®в экстренных случаях, что сделало его первым в Индии одобренным пероральным препаратом фавипиравира для лечения COVID-19 от легкой до умеренной.
Одобрение было предоставлено в рамках ускоренного процесса утверждения с учетом чрезвычайной ситуации, возникшей из-за вспышки COVID-19 в Индии.
Источник: https://www.business-standard.com
15.06.2021