Инновационные лекарственные средства, одобренные FDA США в 2021 году. Анализ ключевых тенденций и достижений
К.В. Балакин, д.х.н., руководитель направления разработки инновационных лекарств Научно-исследовательского института «ХимРар», подготовил и представил обзор лекарственных средств, одобренных национальным регуляторным ведомством США по контролю за лекарственными и пищевыми продуктами (Food and Drug Administration, FDA) в 2021 году.

FDA уже многие годы является своеобразным законодателем мод на мировом рынке фармацевтической разработки, задающим долгосрочные тенденции всей глобальной фарминдустрии. Поэтому мировое профессиональное сообщество с огромным интересом следит за новыми лекарственными препаратами, ежегодно одобряемым FDA.
Несмотря на влияние COVID-19, количество препаратов, одобренных FDA в 2021 году, соответствовало тенденциям последних нескольких лет. Центр оценки и исследования лекарственных средств (CDER) FDA одобрил 50 новых терапевтических средств в 2021 году (средний показатель за 5 лет составляет 51 препарат в год). В дополнение к этим препаратам, Центр по оценке и исследованию биологических препаратов FDA (CBER) одобрил ряд вакцин, включая нашумевшую мРНК-вакцину компании Pfizer, и CAR-T клеточные продукты. Разрешения на экстренное использование (EUA) получили ряд антител и пероральных противовирусных препаратов для COVID-19. Следует отметить, что одобрения по линии CBER и EUA не включаются в официальный ежегодный список новых препаратов FDA.
Противоопухолевые лекарства традиционно доминируют: на них приходится 15 (30%) новых препаратов в списке FDA. Второе место по этому показателю уже третий год подряд занимают неврологические препараты — 5 (10%) новых одобренных средств. Средства терапии инфекционных и сердечно-сосудистых заболеваний поделили третье место, получив по 4 (8%) одобрения.
По химической природе, традиционным лидером являются низкомолекулярные соединения (34 препарата), однако все более значимую и ежегодно усиливающуюся конкуренцию им составляют биологические продукты, которые представлены в 2021 году четырнадцатью белками и двумя олигонуклеотидами. Судя по маркетинговым оценкам, инновационные биотехнологические продукты обеспечивают наибольшую доходность, однако химико-фармацевтические препараты до сих пор доминируют в количественном выражении.
Особенностью регистрационной политики FDA является ранжирование новых препаратов в соответствии со степенью приоритетности, необходимости ускоренного внедрения, инновационности. Так, 34 препарата (68%) получили в 2021 году статус «приоритетных», поскольку они, как ожидает FDA, предлагают значительные улучшения по сравнению со стандартом лечения. Статус «прорывных», т.е. высокоинновационных терапевтических средств, которые способны обеспечить совершенно новые возможности по сравнению с имеющимися методами лечения, получили 14 (28%) препаратов.
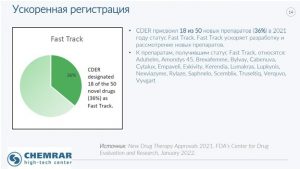
Особое внимание Константин Балакин уделил препаратам, получивших ускоренное одобрение (англ. Fast Track). В 2021 году по этой категории прошли 18 (36%) препаратов на основании улучшения суррогатных, непрямых показателей эффективности, которые, по мнению FDA, с достаточной вероятностью предсказывают клиническую пользу. К числу таких препаратов относятся: Aduhelm, Amondys 45, Brexafemme, Bylvay, Cabenuva, Cytalux, Empaveli, Exkivity, Kerendia, Lumakras, Lupkynis, Nexviazyme, Rylaze, Saphnelo, Scemblix, Truseltiq, Verquvo, Vyvgart. Ключевые данные по каждому из указанных препаратов, включая терапевтическую область, структурно-функциональные параметры, биологические мишени, особенности действия – представлены в докладе*.
Высокая доля ускоренных регистраций (36% от общего числа) коррелирует с большим числом орфанных препаратов (52%). Указанные показатели свидетельствуют о значимых трансформациях в мировой фармразработке, переходящей от модели препаратов-«блокбастеров» к модели создания более персонализированной орфанной терапии. Этой тенденции в полной мере соответствует тот факт, что значительная доля препаратов, проходящих по категориям ускоренной регистрации и орфанных, назначаются исключительно по результатам прохождения пациентами высокотехнологичных молекулярно-биологических тестов, предназначенных для выявления специфических генетических вариантов заболеваний.
В обзоре отмечается, что одобренные в FDA препараты отличает высочайший уровень инновационности; так, FDA определил 27 из 50 новых препаратов, одобренных в 2021 году (54%), как первые в классе, т.е. имеющие механизмы действия, отличные от механизмов действия существующих средств. Прорывной характер разработок также во-многом определяется аспектами персонализации (зачастую орфанного типа), в основном в сочетании с передовыми генетическими тестами.
В медицинско-химическом смысле, в новых разработках от FDA отмечаются многочисленные инновационные решения (напр., дизайн препаратов, направленных на новые биомишени или их мутантные варианты, аллостерических ингибиторов, пролекарств, биоизостерных аналогов и пр.). В качестве иллюстрации, можно привести противоопухолевый препарат соторасиб, ингибитор KRAS-G12C от компании Amgen, проходящий по категориям ускоренной регистрации и первого в классе. Протоонкоген KRAS, входящий в число наиболее часто мутирующих генов в раковых опухолях, был обнаружен более 40 лет назад. Однако он долго оставался «крепким орешком» для медицинского-дизайна ингибиторов из-за отсутствия стерически доступных центров для связывания. Только в 2013 году в Калифорнийском университете был обнаружен аллостерический сайт связывания в этом ферменте, что послужило точкой опоры для дизайна перспективных соединений-ингибиторов. Препарат соторасиб стал первым из этой мишень-ориентированной группы лекарств, получившим одобрение для лечения KRAS-G12C-мутированного немелкоклеточного рака легких (NSCLC).
Несмотря на значительные различия в условиях, в которых действуют национальные регуляторы США и Российской Федерации, представляется, что передовой опыт FDA может дать ценные ориентиры для развития российской фарминдустрии. По мнению Константина Балакина, в первую очередь необходимо обратить внимание на высочайшую инновационность североамериканских разработок. Кроме того, следует внимательно рассмотреть опыт ускоренной регистрации некоторых категорий лекарственных средств, особенно в сочетании с передовыми методами диагностики. Сочетание указанных факторов позволяет не только обеспечивать высокую доходность фармацевтического бизнеса, но и находить новые способы борьбы с самыми опасными заболеваниями.
*Полный обзор и выступление К.В. Балакина можно посмотреть по ссылке https://www.youtube.com/watch?v=ZseqydSlW58&t=4s
Источники: (1) A. Mullard. Nature (News). 2021 FDA approvals. 04 January 2022. (2) New Drug Therapy Approvals 2021. FDA’s Center for Drug Evaluation and Research, January 2022.
(с) Группа компаний ХимРар, 06.07.2022
Использование данного материала обязательно со ссылкой на ГК «ХимРар».
18.07.2022