Insmed получила одобрение FDA на будущий хит продаж — препарат Brinsupri
Brinsupri стал первым препаратом для лечения бронхоэктатической болезни, открыв новый класс ингибиторов дипептидилпептидазы 1 (dipeptidyl peptidase 1, DPP1). По данным американской биофармацевтической корпорации Insmed, Inc. около 500 000 человек в США страдают от немуковисцидозного бронхоэктатического синдрома (non-cystic fibrosis bronchiectasis, NCFB). Препарат Brinsupri (brensocatib) компании Insmed получил двойную победу в регуляторных процедурах, став первым ингибитором DPP1 и первым препаратом для лечения синдрома NCFB, одобренным FDA.

Brinsupri одобрен для лечения немуковисцидозного бронхоэктатического синдрома NCFB у взрослых и детей старше 12 лет. Это заболевание представляет собой форму бронхоэктатической болезни, не вызванную муковисцидозом, а повреждением дыхательных путей, причиной которого, среди прочего, являются инфекции легких или воспалительные заболевания.
В настоящее время бронхоэктатическая болезнь лечится с помощью процедур очищения дыхательных путей, антибиотикотерапии и физических упражнений. Однако до сих пор не было одобрено специальное лечение для этого заболевания. Brinsupri, принимаемый внутрь, выпускается в таблетках по 10 мг и 25 мг.
Фармацевтический аналитик GlobalData Вини Варки (Vinie Varkey) отмечает: «Brinsupri — это первый препарат, разработанный по инструкции, не содержащий антибиотиков, противовоспалительный, обеспечивающий более целенаправленное действие и, возможно, он позволит отказаться от использования антибиотиков при этом заболевании».
Акции компании Insmed, котирующейся на бирже Nasdaq, закрылись на 7,46% выше на закрытии торгов 12 августа и в настоящее время торгуются примерно в 4 раза выше, чем годом ранее, благодаря публикации таких положительных клинических данных.
Одобрение препарата Brinsupri было основано на результатах исследований III фазы ASPEN (NCT04594369) и II фазы WILLOW (NCT03218917). Клиническое исследование ASPEN, в котором приняли участие более 1700 пациентов с NCFB, продемонстрировало значительное снижение ежегодной частоты обострений у пациентов, принимавших препарат. Обострения, также известные как вспышки, являются конечными точками, часто используемыми в исследованиях респираторных заболеваний для оценки эффективности терапии.
У пациентов, получавших Brinsupri в дозе 10 мг, наблюдалось снижение на 21% по сравнению с пациентами, принимавшими плацебо, в то время как у пациентов, получавших дозу 25 мг, наблюдалось снижение на 19%.
Варки добавляет: «Будучи первым на рынке ингибитором DPP1 в области респираторных заболеваний, Brinsupri, вероятно, станет стандартом лечения нефропатии. Ключевые лидеры общественного мнения, опрошенные GlobalData, были воодушевлены способностью Brinsupri снижать частоту обострений и замедлять темпы снижения функции легких».
Компания Insmed подтвердила, что заявки на ее препарат также были поданы в Европейское агентство по лекарственным средствам (EMA) и Агентство по регулированию оборота лекарственных средств и изделий медицинского назначения Великобритании (MHRA), а его коммерческий запуск ожидается в 2026 году. Brinsupri уже доступен в США по рецепту через обширную сеть специализированных аптек.
Будущее Brinsupri по непатентованному показанию выглядит многообещающим. GlobalData считает, что у Insmed есть потенциал для бестселлеров, прогнозируя продажи в размере $1,7 млрд к 2033 году. В презентации для инвесторов Insmed заявила, что препарат может принести $5 млрд на пике продаж. По оценкам Insmed, около 500 000 человек в США страдают от бронхоэктатической болезни. GlobalData прогнозирует, что к 2033 году рынок препаратов для лечения бронхоэктатической болезни составит 8 млн человек (США, Франция, Германия, Италия, Испания, Великобритания, Япония, Китай) и объем в $3,7 млрд.
GlobalData — материнская компания Pharmaceutical Technology.
Brinsupri выходит на рынок вместе с единственным другим коммерческим препаратом Insmed — Arikayce (amikacin), одобренным в 2018 году для лечения заболеваний легких, вызванных Mycobacterium avium complex (MAC).
Варки добавляет: «Для самой Insmed одобрение Brinsupri станет важным шагом на пути укрепления позиций компании, как ключевого игрока в области лечения заболеваний дыхательных путей». Её комментарии ясно указывают на возможность расширения применения ингибиторов DPP1 на другие респираторные показания, что открывает новые возможности для роста биофармацевтических компаний.
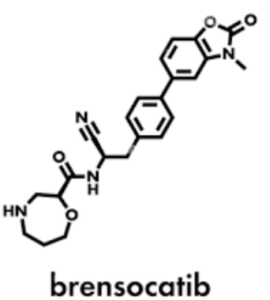
О препарате Brinsupri (brensocatib)
Brensocatib — новый экспериментальный препарат, изучается для лечения бронхоэктатической болезни. Он представляет собой ингибитор дипептидилпептидазы I (также известный как катепсин C). Клиническое исследование фазы 3, известное как исследование ASPEN, было проведено для оценки безопасности и эффективности brensocatib у пациентов с бронхоэктатической болезнью, не связанной с муковисцидозом. Таблетки Brinsupri (brensocatib) компании Insmed Inc. одобрены FDA в августе 2025 года после получения статуса прорывной терапии и рассмотрения в приоритетном порядке.
О компании Insmed
Insmed — глобальная биофармацевтическая компания, ориентированная на лечение людей и стремящаяся предоставлять передовые и лучшие в своем классе методы лечения, чтобы преобразить жизнь пациентов с серьезными заболеваниями. Головной офис Insmed находится в Бриджуотере, штат Нью-Джерси, а офисы и исследовательские центры расположены в США, Европе и Японии. Компанию считают одним из лучших работодателей в биофармацевтической отрасли, также 4 года подряд ее признавали лучшим работодателем в области науки. Компания создана в 1988 году Шарлоттсвилль, штат Вирджиния, дочерняя компания – Insmed Pharmaceuticals, Inc.
Источник: https://www.pharmaceutical-technology.com/
14.08.2025