Johnson & Johnson получила Priority Review от FDA для заявки на препарат против неинвазивного рака мочевого пузыря высокого риска
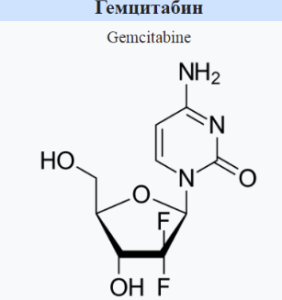
Компания Johnson & Johnson объявила, что FDA предоставило Priority Review заявке на новый препарат TAR-200, внутрипузырной системы высвобождения гемцитабина (gemcitabine), для лечения пациентов с неинвазивным раком мочевого пузыря высокого риска (НРМП-ВР), невосприимчивым к бацилле Кальметта-Герена (БЦЖ, Bacillus Calmette-Guérin, BCG), с карциномой in situ (CIS), с папиллярными опухолями или без них.

TAR-200 вводится в мочевой пузырь кратковременно амбулаторно и остается там в течение трех недель на каждый цикл лечения. Заявка на регистрацию нового препарата поддержана результатами исследования SunRISe-1 фазы 2b.
«TAR-200 представляет собой инновационный подход к доставке лекарств, подобного которому не было десятилетиями», — заявил Юсри Эль-Саид (Yusri Elsayed), руководитель глобального терапевтического направления «Онкология» компании Johnson & Johnson Innovative Medicine. «Приоритетное рассмотрение заявки FDA на TAR-200 подчёркивает нашу миссию — кардинально изменить подход урологов к лечению определённых видов рака мочевого пузыря».
Регламентируемое заявление подкрепляется данными исследования SunRISe-1 фазы 2b, продемонстрировавшего 82,4% полного ответа (ПО), при этом у 52,9% пациентов рак не выявлялся как минимум в течение года или более после достижения ПО. Большинство нежелательных реакций были лёгкими и умеренными. Наиболее частые побочные реакции (≥10%) включали поллакиурию, дизурию, инфекцию мочевыводящих путей, императивные позывы к мочеиспусканию, гематурию, неинфекционный цистит и боль в мочевыводящих путях. Системных побочных реакций не зарегистрировано. Результаты исследования были представлены на пленарном заседании ежегодного собрания Американской урологической ассоциации в апреле 2025 года (April 2025 American Urological Association Annual Meeting).
Несмотря на достигнутые успехи, стандарты лечения пациентов с НРМП-ВР за последние 40 лет практически не изменились, и у пациентов ограничены возможности лечения в случае неэффективности начальной терапии БЦЖ. TAR-200 — первая и единственная система внутрипузырного высвобождения препарата (iDRS), разработанная для обеспечения устойчивой локальной доставки противоракового препарата в мочевой пузырь. TAR-200 остается в мочевом пузыре в течение трех недель на цикл лечения. Медицинский работник вводит его в мочевой пузырь с помощью катетера в амбулаторных условиях менее чем за пять минут. Общая анестезия, дальнейшее наблюдение или другие ограничения не требуются .
О TAR-200
TAR-200 — это экспериментальная внутрипузырная система высвобождения гемцитабина. В январе 2025 года компания Johnson & Johnson объявила о начале подачи заявки на регистрацию TAR-200 в FDA в рамках программы Real-Time Oncology Review (RTOR). В декабре 2023 года FDA присвоило TAR-200 статус «прорыв в терапии» (BTD) для лечения взрослых пациентов с невосприимчивым к БЦЖ НРМП-ВР с CIS, которым не показана радикальная цистэктомия или которые отказались от нее. Безопасность и эффективность TAR-200 оцениваются в исследованиях 2 и 3 фазы у пациентов в группах SunRISe-1, SunRISe-3 и SunRISe-5, а также с мышечно-инвазивным раком мочевого пузыря (MIBC) в группе SunRISe-4.
О SunRISe-1, когорта 2
SunRISe-1 (NCT04640623), когорта 2, — это открытое клиническое исследование фазы 2b с одной группой, оценивающее безопасность и эффективность монотерапии TAR-200 у пациентов с раком in situ (CIS), невосприимчивых к БЦЖ, с высоким уровнем риска развития НРМП-ВР, с наличием папиллярных опухолей или без них, которым не показана радикальная цистэктомия или которые отказались от нее. Первичной конечной точкой для когорты 2 является частота полного ответа (ПО) в любой момент времени, а вторичными конечными точками являются продолжительность ответа (ПО), безопасность, общая выживаемость и качество жизни.

О неинвазивном раке мочевого пузыря высокого риска (НРМП-ВР)
НРМП-ВР высокого риска (НРМП-ВР) — это тип неинвазивного рака мочевого пузыря, который с большей вероятностью рецидивирует или распространяется за пределы слизистой оболочки мочевого пузыря, называемой уротелием, и прогрессирует до инвазивного рака мочевого пузыря по сравнению с НРМП-ВР низкого риска. НРМП-ВР характеризуется высокой степенью злокачественности, большим размером опухоли, наличием множественных опухолей и наличием карциномы in situ (CIS). Пациенты с НРМП-ВР с CIS составляют примерно 10% от общего числа пациентов с ВРМП. Бацилла Кальметта-Герена (БЦЖ) – это внутрипузырный препарат, вводимый непосредственно в мочевой пузырь, который пациенты должны удерживать в течение нескольких часов. БЦЖ – это ослабленная форма бактерий, используемых для лечения туберкулеза, и, несмотря на эффективность, у некоторых пациентов наблюдается невосприимчивость к препарату и проблемы с переносимостью. Радикальная цистэктомия в настоящее время рекомендуется пациентам с НРМП-ВР, которым не помогла терапия БЦЖ. Это операция, которая меняет жизнь, характеризуется высокой степенью заболеваемости и негативного влияния на качество жизни, а уровень послеоперационной смертности составляет от трех до восьми процентов.8,9 Учитывая, что НРМП-ВР обычно поражает пожилых пациентов, многие из них могут не захотеть или не иметь возможности пройти радикальную цистэктомию.
Источник: https://www.prnewswire.com/
18.07.2025