Консультативный комитет FDA по онкологическим препаратам обсудит три противораковых NDA-препарата
FDA запланировало заседание своего Консультативного комитета по онкологическим препаратам на 22 и 23 сентября для обсуждения новых заявок на лекарства (NDA) для трех противораковых препаратов.

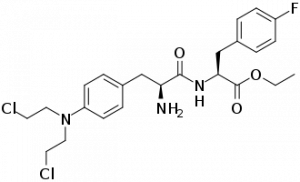
Комитет рассмотрит обновленный NDA от Oncopeptides для его инъекционного препарата Pepaxto (melflufen, melphalan flufenamide, флуфенамид), которому FDA предоставило ускоренное одобрение в комбинации с дексаметазоном для взрослых пациентов с рецидивирующей или рефрактерной множественной миеломой, которые получили по крайней мере четыре предшествующие линии терапии и чье заболевание рефрактерно к как минимум одному ингибитору протеасом, одному иммуномодулирующему агенту и одному CD38-направленному моноклональному антителу. Является первым в своем классе конъюгатом пептид-лекарственного средства.
Pepaxto
Pepaxto был одобрен для медицинского применения в США в феврале 2021 г. Послепродажное клиническое исследование препарата дало неутешительные результаты. 22 октября 2021 г. Pepaxto был снят с фармрынка США и больше не доступен для новых рецептов.
Copiktra
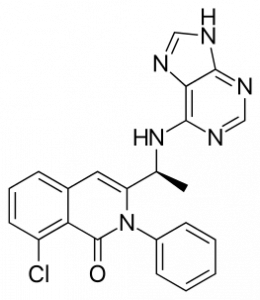
Комитет также обсудит NDA для капсульного препарата Copiktra (duvelisib, дувелисиб) компании Secura Bio для использования при лечении взрослых пациентов с рецидивирующим или рефрактерным хроническим лимфолейкозом или мелколимфоцитарной лимфомой после как минимум двух предшествующих терапий. Его принимают внутрь. Это — ингибитор киназы PI3, двойной ингибитор PI3Kδ и PI3Kγ. Группа рассмотрит преимущества и риски препарата на основе обновленной информации об общей выживаемости и данных о безопасности. Ранее FDA предупреждал о возможном повышенном риске смерти и серьезных побочных эффектах Copiktra.
Poziotinib
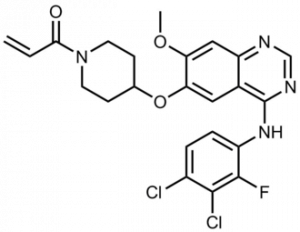
Группа экспертов также обсудит NDA компании Spectrum Pharmaceuticals в отношении лекарства Poziotinib (NOV120101, HM781-36B, позитиониб) для лечения пациентов с ранее леченным местнораспространенным или метастатическим немелкоклеточным раком легкого, содержащим мутации экзона 20 рецептора эпидермального фактора роста человека (HER2) 20. Это препарат, разработанный Hanmi Pharmaceutical (в Южной Корее), Luye Pharma (Китай) и Spectrum Pharmaceuticals (остальные страны) для лечения различных видов рака. Он построен на анилино-хиназолиновой основе и ингибирует рецепторы эпидермального фактора роста EGFR, HER2/neu и Her 4 и ковалентно связывается со своими мишенями. В августе 2014 года Hanmi передала эксклюзивные права в Китае китайской компании Luye Pharma, а в феврале 2015 года — Spectrum в остальном мире за пределами Южной Кореи.
Источник: https://www.fdanews.com/
Источник: https://www.fda.gov/drugs/
27.07.2022