Меры поддержки инновационных разработок в фармацевтике: новое партнерство государства и бизнеса
7 октября 2025 г. на форуме «Биопром» состоялась сессия «Государство и бизнес в фарминновациях: новые инструменты поддержки — от клиники до производства». Ключевой темой дискуссии стало формирование новой модели партнерства для создания в России устойчивой экосистемы разработки и коммерциализации инновационных препаратов.
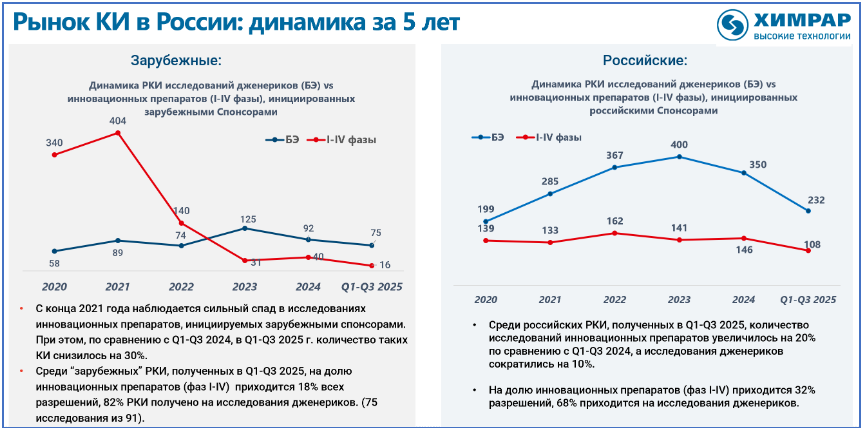
С 2022 года на российском рынке количество клинических исследований инновационных препаратов, инициируемых зарубежными компаниями, снизилось в 10 раз. В настоящее время в клинике находятся преимущественно дженерики и биоподобные препараты. При этом за последние четыре года в мире появились порядка ста инновационных препаратов и технологий, недоступных в России. Если в ближайшее время не будет предпринято никаких мер для развития собственных инноваций, и отрасль продолжит ориентироваться на дженерики и импортозамещение, то через 3−5 лет мы будем вынуждены регистрировать западные, или скорее восточные, препараты следующего поколения без клинических испытаний у нас, потому что лечить резистентные формы болезней, которые разовьются на текущих стандартах лечения, станет нечем.
Для этого нужны системные меры со стороны государства, особенно актуально финансирование «долины смерти» — первой и второй фаз клинических исследований, где сейчас существует разрыв инновационного цикла, как это было сделано в рамках программы «Фарма-2020». Эксперты считают, что его вполне возможно преодолеть в обозримые сроки.
В частности, пример Китая показывает, что системная стратегия — поддержка через финансовые гранты, регуляторные упрощения, создание инфраструктурных кластеров и национальные программы привели к значительному росту фармрынка и экспорту инновационных препаратов. За последние 15 лет Китай сделал настоящий рывок: количество клинических исследований фаз I–III выросло кратно. Сегодня по абсолютным цифрам Китай уже опередил Европу и вплотную приблизился к США. В относительном выражении его доля в глобальных клинических исследованиях выросла с 3–4% до почти 30%. Это определяет полную автономность Китая в области фармацевтики за счет развития собственных инновационных препаратов.
Илья Иващенко, генеральный директор компании «Авифарма» ГК ХимРар, в своем выступлении привел сравнительные данные: «В России на текущий момент выдано 42 разрешения на первую фазу клинических исследований и 17 на вторую, в то время как в Китае на аналогичных стадиях находится более 3000 проектов. Основная причина – отсутствие финансирования и программ поддержки для исследовательских проектов на этапе клиники в фарме. Они не финансируются в России в значимых и необходимых количествах».
В настоящее время Минздрав финансирует разработку лекарств только в своих подведах, Минобрнауки выделяет средства на ранние поисковые исследования, Минпромторг планирует субсидии в виде «кэшбэка» за клинику после выхода препарата на рынок, но этих мер недостаточно. Большинство малых и средних компаний не могут найти средств для проведения критических, высокорискованных стадий Proof of Concept, чтобы дожить до момента возврата инвестиций (кэшбэка). Между тем, именно этот сегмент бизнеса обеспечивает порядка двух третей инноваций в развитых экономиках.
«Чтобы кратно увеличить количество инновационных разработок, помимо государственных грантов и субсидий на 1-2 фазы КИ, у нас должны появиться специализированные венчурные фонды, которые финансировали бы фармацевтические проекты до того момента, когда они могут быть поддержаны индустрией. Несколько лет назад был создан Unicorn Capital Partners, но за несколько лет существования он проинвестировал единицы проектов, а для того, чтобы мы начали говорить об инновационной фарме и государственном суверенитете в этой области, таких проектов должно быть в сто раз больше. Поэтому и фондов таких нужно больше», — говорит Иващенко.

АНО «Инновационный инжиниринговый центр» (Иннопрактика) совместно с Комитетом по инновационной фармацевтике Ассоциации «Национальные чемпионы» прорабатывает параметры специализированной программы для инновационной фармацевтики, базирующейся на принципах программы «доращивания», которая уже успешно реализуется в диптехе. Ее идея заключается в том, что компании получают «стартовый заказ» от государства (какие препараты нужно разработать для нашей системы здравоохранения), и гранты на эти разработки, а также поддержку вывода продукции как на российский рынок, так и на экспорт.
Роль координатора, определяющего направления разработок и спрос на продукт, взял на себя межведомственный Координационный орган, включающий представителей Минздрава, Минобрнауки, Минпромторга России и Иннопрактики.
Олег Корзинов, руководитель рабочей группы «Технологии» Межведомственного координационного совета по развитию отечественных фарминноваций, советник ректора МФТИ, рассказал, что совет формирует национальный портфель перспективных инноваций, ориентированных как на внутренний рынок, так и на экспорт в дружественные страны. Работа сосредоточена на создании эффективных механизмов взаимодействия между федеральными органами власти и регуляторными структурами, что поможет снизить административные барьеры и ускорить принятие решений. Основные направления реализации инноваций включают поддержку разработки новых препаратов, совершенствование регуляторных механизмов и формирование стартового государственного заказа, обеспечивающего комплексную поддержку на всех этапах исследований — от доклинических до клинических.
В рамках совета созданы рабочие группы для приоритизации технологий и выбора перспективных биомишеней, с особым вниманием к биомедицинским направлениям, включая моноклональные антитела и мультибиомеханические технологии.
Также разрабатывается матрица мер поддержки отечественных фармкомпаний, включая финансовые инструменты, создание венчурных фондов и стимулирование ранних исследований через гранты.
Видео-запись сессии: https://rutube.ru/video/d5513f1ae2d53b2e13a542b29d0b10d3/
23.10.2025