Минздрав Японии одобрил препарат Daiichi Sankyo’s от рака груди
Министерство здравоохранения, труда и социального обеспечения Японии (Ministry of Health Labour and Welfare, MHLW) одобрило препарат Enhertu (trastuzumab deruxtecan, трастузумаб дерукстекан) компании Daiichi Sankyo для лечения HER2-положительного нерезектабельного или рецидивирующего рака молочной железы у взрослых. Одобрение было основано на результатах исследования Enhertu в клиническом исследовании (КИ) DESTINY-Breast03 фазы III. В этом КИ препарат показал снижение риска прогрессирования заболевания или смертности у пациентов с раком молочной железы на 72%.

Лечение показано пациентам после предшествующей химиотерапии. В международном прямом открытом рандомизированном КИ III фазы DESTINY-Breast03 анализировалась эффективность и безопасность Enhertu сравнительно с trastuzumab emtansine (трастузумабом эмтанзином) (T-DM1).
У субъектов, получавших Enhertu, медиана выживаемости без прогрессирования (progression-free survival, PFS) не была достигнута – по сравнению с зафиксированными 6,8 месяца в группе T-DM1.
Профиль безопасности Enhertu в этом КИ соответствовал профилям, наблюдаемым в предыдущих исследованиях, без каких-либо новых проблем безопасности.
Тошнота, утомляемость, рвота, снижение количества нейтрофилов, алопеция и анемия, среди прочего, были наиболее распространенными побочными реакциями.
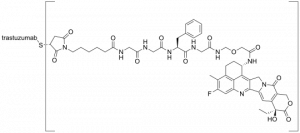
Конъюгат антитело-лекарственное средство (antibody-drug conjugate, ADC) Enhertu содержит моноклональное антитело HER2, связанное с полезной нагрузкой ингибитора топоизомеразы I через стабильный расщепляемый линкер на основе тетрапептида.
Глава отдела исследований и разработок Daiichi Sankyo в Японии и исполнительный директор Ватару Такасаки (Wataru Takasaki) сказал: «Мы гордимся качеством и скоростью, с которой нам удалось провести подтверждающее исследование фазы III, которое продемонстрировало превосходство Enhertu в увеличении выживаемости без прогрессирования заболевания, сравнительно с T-DM1 у пациенток с ранее леченным HER2-положительным метастатическим раком молочной железы.
Такое одобрение от MHLW подчеркивает важность системы условного одобрения в Японии, позволяющей заблаговременно одобрять лекарства для лечения серьезных заболеваний, таких как рак молочной железы.
В августе этого года Enhertu получил одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США для лечения взрослых пациентов с нерезектабельным или метастатическим немелкоклеточным раком легкого.

Trastuzumab deruxtecan
Trastuzumab deruxtecan, продаваемый под торговой маркой Enhertu, представляет собой конъюгат антитело-лекарственное средство, состоящий из гуманизированного моноклонального антитела трастузумаб (herceptin, герцептин), ковалентно связанного с ингибитором топоизомеразы I deruxtecan (производным exatecan). Он лицензирован для лечения рака молочной железы, аденокарциномы желудка или желудочно-пищеводного тракта.
Трастузумаб связывается с рецептором эпидермального фактора роста 2 (HER2/neu) и блокирует передачу сигналов при раке. Кроме того, после связывания с рецепторами HER2 антитело интернализуется клеткой, неся вместе с собой связанный дерукстекан, где он препятствует способности клетки вносить структурные изменения ДНК и реплицировать свою ДНК во время клеточного деления. Последнее приводит к повреждению ДНК, когда клетка пытается воспроизвести себя.
Препарат был одобрен для медицинского использования в США в декабре 2019 г., в Японии — в марте 2020 г., в Европейском Союзе — в январе 2021 г., и в Австралии — в октябре 2021 г. Однако, trastuzumab deruxtecan— это первая одобренная Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) терапия, предназначенная для людей с подтипом HER2-низкого подтипа HER2-негативного рака молочной железы.
Источник: https://www.pharmaceutical-technology.com
28.11.2022