Мышечная дистрофия Дюшенна останется без аталурена
Очередная попытка «ПиТиСи терапьютикс» (PTC Therapeutics) зарегистрировать в США «Трансларна» (Translarna, аталурен) для терапии мышечной дистрофии Дюшенна с нонсенс-мутациями столкнется, скорее всего, с отказом. Консультативный комитет при Управлении по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) заявил о необходимости проведения дополнительного изучения аталурена, чтобы выяснить, улучшает ли он способность пациентов передвигаться.
Эксперты сообщили, что «ПиТиСи» не предоставила убедительных доказательств эффективности препарата: заявитель лишь показал результаты многочисленных ретроспективных и поисковых клинических испытаний, призванных смягчить итоги двух безуспешных клинических исследований. Биржевые котировки «ПиТиСи» обвалились почти на 20%.
В феврале 2016 года FDA отказало в одобрении «Трансларна» по причине неполноты регистрационного досье. В октябре регулятор отклонил поданную апелляцию, хотя в марте 2017-го всё же принял повторную заявку.
В августе 2014 года Европейское агентство по лекарственным средствам (EMA) условно утвердило аталурен. В январе 2017 года Европейская комиссия ратифицировала рекомендации регулятора на возобновление искомого условного одобрения.
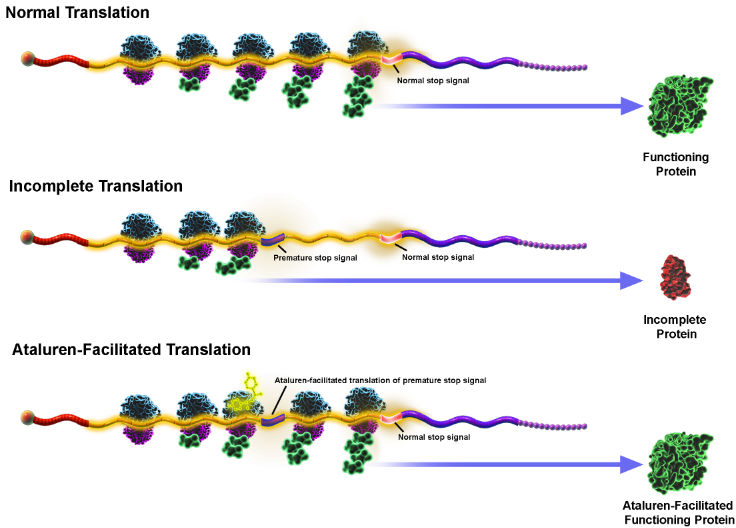
Аталурен, будучи модулятором транскрипции, относится к восстанавливающим протеины препаратам для страдающих генетическими патологиями, вызванными нонсенс-мутациями. Последние представляют собой изменения в генетическом коде, преждевременно останавливающие синтез незаменимых белков. Аталурен делает рибосомы менее чувствительными к преждевременным стоп-кодонам посредством организации вставки определенных родственных тРНК близ сайта нонсенс-кодонов. При этом не оказывается эффекта на нисходящую транскрипцию, мРНК-процессинг, стабильность мРНК и результирующего протеина. В итоге функциональный белок становится похожим на немутировавший эндогенный продукт.
В 2016 году «Трансларна», доступный в Европе, Израиле и Южной Корее, заработал скромные 81 млн долларов. В 2022 году он выйдет, если верить прогнозам EvaluatePharma, на отметку в 117 млн долларов.
«ПиТиСи» проверяла аталурен на муковисцидозе с нонсенс-мутациями — ничего не получилось: направление признано бесперспективным.
Тем временем отлично развивается бизнес «Сарепта терапьютикс» (Sarepta Therapeutics), которая в сентябре 2016 года вывела на сцену «Эксондис 51» (Exondys 51, этеплирсен), ориентированный на миодистрофию Дюшенна с подтвержденной мутацией гена дистрофина, приводящей к пропуску экзона 53. Что показательно, разрешение на этот антисмысловой морфолиновый олигонуклеотид было получено без явных доказательств клинической эффективности по части улучшения моторики. В 2022 году продажи «Эксондис 51», согласно ожиданиям EvaluatePharma, доберутся до 740 млн долларов.
«Сарепта» семимильными шагами продвигается к запуску голодирсена (golodirsen), нацеленного на мышечную дистрофию Дюшенна с пропуском экзона 53. Вообще в планах стоит охватить как можно более широкую популяцию пациентов, пригодных к антисмысловой терапии: таковых насчитывается приблизительно 80%. Однако под каждый генотип этого редкого дегенеративного нервно-мышечного заболевания придется создавать свой препарат.
Попутно продолжается разработка генной терапии миодистрофии Дюшенна на основе вирусного вектора, несущего корректный ген микро- или мини-дистрофина. Кроме того, исследуется так называемая суррогатная генотерапия с вирус-векторным переносом гена GALGT2, кодирующего протеин GalNAc (бета 1,4-N-ацетилгалактозамин галактозилтрансфераза).
В феврале 2017 года FDA утвердило «Эмфлаза» (Emflaza, дефлазакорт): старый глюкокортикостероид, существующий на мировом рынке десятилетиями, официально появился в Соединенных Штатах по изумительно безумной цене — 89 тыс. долларов в год. Впрочем, после возмущения американского сообщества, совсем не обрадовавшегося вырисовывающейся перспективе приобретать лекарство по чересчур завышенной стоимости, ценник был сброшен до 35 тыс. долларов. Дефлазакорт, на который разрешение получила «Марафон фармасьютикалс» (Marathon Pharmaceuticals), но которая затем избавилась от этого рискового актива, продав его «ПиТиСи», обходится за пределами США в годовую сумму в пределах 1 тыс. долларов.
«Катабасис фармасьютикалс» (Catabasis Pharmaceuticals) продолжает верить в силу эдасалонексента (edasalonexent), который вполне может стать тем самым прорывным лекарством, меняющим течение мышечной дистрофии Дюшенна. Однако экспериментальная молекула, выступающая ингибитором транскрипционного фактора NF-ϰB (ядерный фактор «каппа-би»), пока не в фаворе.
У швейцарской «Сантера фармасьютикалс» (Santhera Pharmaceuticals) не получается расширить спектр показаний для «Раксона» (Raxone, идебенон). Этот спорный препарат, уже разрешенный против врожденной атрофии зрительного нерва Лебера, ищет новое назначение — для замедления снижения респираторной функции у пациентов с мышечной дистрофией Дюшенна, не принимающих глюкокортикостероиды.
Источник: http://mosmedpreparaty.ru
29.09.2017