Наночастицы в тандеме с антибиотиками эффективно уничтожают резистентные бактерии
Китайские и британские ученые одели наночастицы золота в двойную оболочку, сделав их одновременно биосовместимыми и эффективными против бактерий. Полученные наночастицы отлично справлялись с бактериальными инфекциями на коже крыс и в одиночку, но еще эффективнее работали в тандеме с антибиотиком. Результаты исследования опубликованы в журнале Chemical Science.
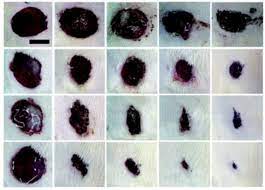
Резистентность к антибиотикам — серьезная проблема современной медицины. Заболевания, которые вызваны резистентными бактериями, с трудом поддаются лечению, а иногда и вовсе не лечатся.
Для борьбы с такими бактериями биологи и медики постоянно ищут новые подходы, и один из вариантов — терапия металлическими наночастицами. Металлические наночастицы могут как воздействовать на бактерии самостоятельно (повреждая мембраны бактерий и генерируя радикальные частицы), так и усиливать эффект антибиотиков. Однако сделать эффективное лекарство на основе наночастиц не так просто. Чтобы наночастицы эффективно атаковали бактерий, металл укутывают в оболочку из органических лигандов. Зачастую та же самая оболочка повышает токсичность наночастиц и замедляет их выведение из организма.
Элегантное решение для этой проблемы предложили китайские и британские химики под руководством Синъюя Цзяна (Xingyu Jiang) из Южного научно-технологического университета в Гуандуне. Они одели золотые наночастицы в оболочку из двух типов лигандов — к цетилпиридиниевым лигандам (P12), которые за счет положительного заряда на поверхности помогают частицам связываться с грамположительными бактериями, добавили цвиттер-ионы, которые должны отвечать за стабильность и биосовместимость.
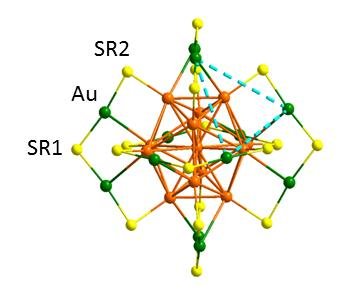
Кристаллическая наноструктура Au25 (SR) 18 (= Au25 (SR1) 6 (SR2) 12) указывает на два типа тиолатных лигандов «- (SR2) -Au- (SR1) -Au- (SR2) -» . Цветовые обозначения: Au на оболочке скобы (зеленый); Au в ядре Au13 (оранжевый); сера (желтая). Атомы углерода и водорода не показаны для ясности. Цитируется по: https://www.researchgate.net/
Ученые работали с хорошо известными в литературе наночастицами состава Au25(SR)18 — стабильными и водорастворимыми. Существующие методики позволяют делать такие частицы однородными по размеру — каждая содержит ровно 25 атомов золота. А благодаря небольшому размеру выполнившие свою задачу частицы быстро выводятся из организма.
Чтобы синтезировать наночастицы в двойной оболочке, авторы сначала отдельно синтезировали и очищали каждый лиганд, а затем смешивали их с источником золота (тетрагидратом тетрахлороаурата водорода H[AuCl4]· 4H2O) и добавляли восстановитель в щелочной среде. В поисках идеального состава оболочки ученые варьировали соотношение лигандов — всего они приготовили десять разных вариантов наночастиц.
Как показал метод просвечивающей электронной микроскопии, на размер частиц состав оболочки никак не повлиял — все они имели диаметр около 1,2 нанометров.
Антибактериальную активность проверили на штаммах грамположительных бактерий, среди которых был и штамм золотистого стафилококка, резистентного к антибиотику метициллину. Цзянь и его коллеги ожидали, что лучшую антибактериальную активность покажут частицы с высоким содержанием P12 — ведь именно этот лиганд помогает золоту проникать через мембрану бактерий. Однако, результат получился неожиданным: активность проходила через максимум в районе 45-50 мольных процентов P12, потом снижалась, и только после 70 процентов снова начинала повышаться и достигала второго максимума при 100 мольных процентах. В то же время цитотоксичность наночастиц ожидаемо убывала с повышением содержания P12. В итоге авторы решили остановиться на 45 процентах P12 и 55 процентах цвиттер-ионов.
Для финальной проверки антибактериальной активности наночастиц выбрали штамм эпидермального стафилококка, резистентного к метициллину. Наночастицы тестировали как изолированно, так и совместно с тремя популярными антибиотиками — имипенемом, оксациллином и эритромицином. Использование наночастиц позволило за двадцать четыре часа уменьшить количество бактерий в 105 раз, а добавка любого из трех антибиотиков дополнительно усиливала антибактериальную активность. Самый эффективный тандем получился с имипенемом — за те же двадцать четыре часа популяция бактерий сократилась уже в 107 раз.
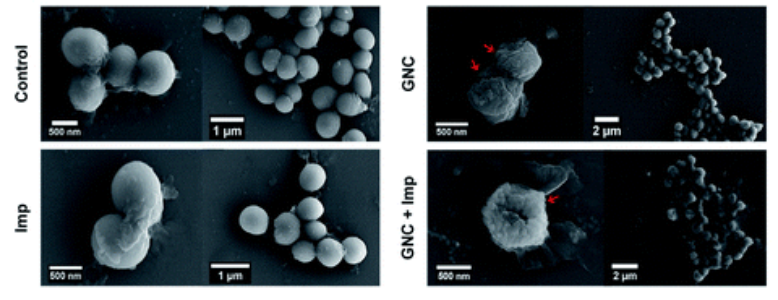
Фотографии бактерий до обработки и после обработки наночастицами золота (GNC) и имипенемом (Imp)
Pang et al / Chemical Science, 2021
Антибактериальное действие золотых наночастиц реализуется через три механизма. Во-первых, цетилпиридиний связывается с остатками тейхоевой кислоты на поверхности грамположительных бактерий, что способствует слипанию бактерий и мешает им размножаться. Кроме того прилипшие к бактерие наночастицы изменяют потенциал мембраны и мешают работе важных бактериальных ферментов. И наконец, наночастицы генерируют радикалы кислорода, которые также могут повреждать мембраны бактерий. Все это помогает имипенему проникнуть через мембрану и усиливает его собственную антибактериальную активность, которая в основном основана на подавлении синтеза клеточных стенок бактерий.
Синергия наночастиц и антибиотиков сохраняется и при использовании in vivo — авторы продемонстрировали это на лечении кожных инфекций у крыс. При использовании наночастиц вместе с имипенемом рана заметно сокращалась уже за три дня и полностью затягивалась за двенадцать дней. У тех крыс, которых лечили только наночастицами или только антибиотиком раны затягивались медленнее, а у крыс из контрольной группы, которых не лечили ничем, в тех же условиях наблюдалась даже отрицательная динамика — раны росли и количество бактерий в них увеличивалось.
Авторы полагают, что технологию двойной оболочки можно будет использовать и для других типов наночастиц — не только для борьбы с бактериями, но и, например, для гипертермии.
Терапия наночастицами — не единственный способ борьбы с резистентными бактериями. В октябре канадские ученые создали плазмиду со встроенным комплексом CRISPR/Cas9, которая уничтожила резистентных бактерий в кишечнике мыши. А в начале ноября вышла статья американских биоинженеров, которые разработали новый способ тестирования бактерий на резистентность к антибиотикам. Вместо выращивания бактерий в чашках Петри ученые предложили измерять интенсивность клеточного дыхания. Благодаря этому результат можно получить всего за полтора часа.
Источник: https://nplus1.ru
24.11.2021