Доступ пациентов к терапии Ibrance обеспечен новым руководством NICE
Тысячи пациентов с определенной формой рака молочной железы в Англии и Уэльсе могут быть уверены, что они по-прежнему будут иметь доступ к таргетной терапии Ibrance (palbociclib) от Pfizer благодаря новому руководству (UK’s National Institute for Health and Care Excellence) NICE.

Агентство по экономической эффективности (Сost-effectiveness agency) заявило, что Ibrance (palbociclib) плюс fulvestrant могут регулярно использоваться Национальной службой здравоохранения (National Health Service, NHS) в качестве терапии второй линии для пациентов с прогрессирующим гормональным рецептор-положительным, HER2-отрицательным раком молочной железы, которые уже лечились гормональными препаратами.

Эта стадия рака молочной железы считается неизлечимой, и возможности лечения ограничены: только 15% пациентов живут более пяти лет.
Ингибитор CDK4/6 Ibrance доступен с 2020 года для пациентов этой группы через Фонд противораковых препаратов (Cancer Drugs Fund, CDF), что обеспечивает временный доступ на время сбора дополнительных доказательств ценности терапии.
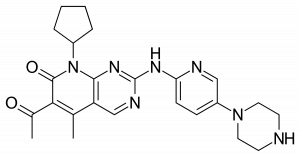
Ibrance (palbociclib)
Теперь, основываясь на результатах последующего клинического исследовании PALOMA-3 и дополнительных данных, собранных о пациентах, получавших Ibrance в Великобритании, было принято решение вывести препарат из CDF и включить в обычное финансирование NHS.
«После медианы наблюдения в 73,3 месяца в исследовании медиана общей выживаемости была на 6,8 месяца больше у людей, получавших palbociclib плюс fulvestrant, по сравнению с теми, кто получал плацебо плюс fulvestrant», — говорится в опубликованном сегодня проекте окончательного заключения обозревателей NICE.
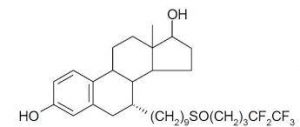
fulvestrant
«Сегодняшнее решение — обнадеживающая новость для почти 2400 человек с распространенным раком молочной железы, которые уже прошли эндокринное лечение», — говорит Хелен Найт, и.о. директора по оценке лекарств в NICE, она также отметила, что подход CDF работает хорошо.
«Как показывает наша оценка palbociclib, хорошо, когда компании сотрудничают с NICE и NHS England, чтобы установить разумную цену на свои лекарства и представить четкие аргументы в пользу сбора дополнительных доказательств, пока они находятся в CDF», — добавила она.
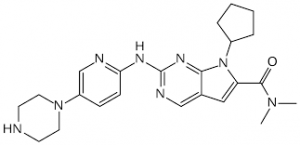
Kisqali (ribociclib)
Два других ингибитора CDK4/6 — Kisqali (ribociclib) от Novartis и Verzenios (abemaciclib) от Eli Lilly — уже одобрены NICE для использования как в первой, так и во второй линии при наиболее распространенном раке молочной железы HR+/HER2-. На этот тип рака молочной железы приходится более 60% всех диагнозов.
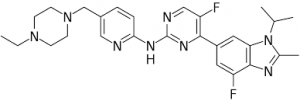
Verzenios (abemaciclib)
Как и в случае с Ibrance, ранее доступность препарата для пациентов была обеспечена через CDF, пока не были собраны дополнительные доказательства эффективности. Kisqali и Verzenios перешли на обычное финансирование в прошлом году.
Keytruda поддержала адъювантную терапию
Также на этой неделе NICE рекомендовал иммунотерапию рака Keytruda (pembrolizumab) Merck&Co/MSD в качестве адъювантного (послеоперационного) лечения пациентов с меланомой в возрасте 12 лет и старше, а также взрослых с почечно-клеточным раком (renal cell carcinoma, RCC).
Эти решения означают, что у пациентов с меланомой на ранних стадиях и RCC впервые может появиться вариант иммунотерапии для снижения риска рецидива рака после операции.
Keytruda (pembrolizumab) — monoclonal antibody
Вчера ингибитор PD-1 был одобрен для рутинного использования NHS в качестве варианта адъювантного лечения пациентов с RCC с повышенным риском рецидива после нефрэктомии, с резекцией метастатического поражения или без нее. И сегодня утром NICE дал зеленый свет на использование препарата у пациентов с меланомой стадии IIB/IIC, перенесших полную резекцию, улучшив его ранний доступ через CDF.
Источник: https://pharmaphorum.com/
27.09.2022