Одобрен первый препарат для лечения редкого дефицита тимидинкиназы 2
FDA одобрило препарат KYGEVVI (doxecitine и doxribtimine) компании UCB — первый и единственный препарат для лечения дефицита тимидинкиназы 2 (thymidine kinase 2 deficiency, TK2d) у взрослых и детей с началом симптомов в возрасте 12 лет и младше.

Одобрение регулятора основано на данных, продемонстрировавших, что KYGEVVI снизил общий риск смерти с начала лечения на 86% сравнительно с контрольной группой.
Дефицит тимидинкиназы 2 (TK2d) — крайне редкое (1,64 случая на 1 000 000 человек), часто фатальное генетическое митохондриальное заболевание, характеризующееся прогрессирующей и выраженной мышечной слабостью. Пациенты с первыми симптомами в возрасте 12 лет и младше подвержены высокому риску преждевременной смерти (часто в течение трёх лет после появления симптомов). Это изнурительное заболевание, серьёзно влияющее на повседневную жизнь, включая способность ходить, есть и дышать самостоятельно. Ранее не было одобрено никаких вариантов лечения, кроме поддерживающей терапии.
«Трудно переоценить важность одобрения FDA для пациентов с диагнозом TK2d. Это сообщество пациентов с крайне редким заболеванием, остро нуждающихся в вариантах лечения. Слишком долго ухаживающим за пациентами и их семьям приходилось нести бремя этого заболевания», — заявила Кристен Клиффорд (Kristen Clifford), президент и генеральный директор Объединенного фонда митохондриальных заболеваний (United Mitochondrial Disease Foundation). «Наличие первой в истории одобренной FDA терапии TK2d для этой группы пациентов не только отвечает важнейшей медицинской потребности, но и представляет собой нечто большее — надежду на будущее».
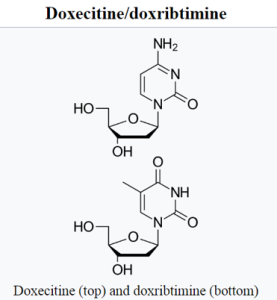
KYGEVVI представляет собой комбинацию doxecitine и doxribtimine — пиримидиновых нуклеозидов. Назначение KYGEVVI направлено на включение doxecitine и doxribtimine, в митохондриальную ДНК скелетных мышц. Это действие восстанавливает количество копий митохондриальной ДНК у мышей с мутацией TK2d.

Рекомендация KYGEVVI подтверждена данными по безопасности и эффективности, полученными в ходе одного клинического исследования II фазы, двух ретроспективных исследований с обзорами медицинских карт и программы расширенного доступа. В этих исследованиях приняли участие 82 пациента, получавших KYGEVVI или пиримидиновые нуклеозиды в возрасте ≤12 лет с началом симптомов TK2d.
«Я изучаю митохондриальные заболевания более трёх десятилетий и лично наблюдал влияние TK2d на пациентов и их семьи. Мы много лет ждали одобрения препарата, и это одобрение знаменует собой важную веху в том, как мы можем поддерживать и контролировать это изнурительное заболевание», — сказал Мичио Хирано (Michio Hirano), руководитель отделения нервно-мышечной медицины в Медицинском центре Ирвинга Колумбийского университета (Division of Neuromuscular Medicine at Columbia University Irving Medical Center).
В настоящее время EMA (Европейское агентство по лекарственным средствам) проводит регуляторный обзор doxecitine и doxribtimine, запланированы дальнейшие подачи заявок на регистрацию. KYGEVVI в настоящее время не одобрен для применения по каким-либо показаниям ни одним регулирующим органом за пределами США. В США KYGEVVI получил от FDA статусы Orphan Drug, Breakthrough, Priority Review, и Rare Pediatric Disease designations. После одобрения FDA компания UCB получила ваучер на приоритетное рассмотрение заявки на регистрацию препарата для лечения редких детских заболеваний (Rare Pediatric Disease Priority Review Voucher, RPDPRV), который можно использовать для приоритетного рассмотрения будущей заявки на регистрацию.
UCB ожидает, что KYGEVVI поступит в продажу в США в первом квартале 2026 года. Это третье одобрение FDA для препарата UCB в отношении редких заболеваний менее чем за 3 года. Одобрение KYGEVVI подтверждено данными по безопасности и эффективности, полученными в ходе одного клинического исследования II фазы (исследование 1, NCT03845712), двух ретроспективных обзорных исследований (исследование 1 и исследование 2, NCT03701568 и NCT05017818, соответственно), а также программы расширенного доступа к препарату (NCT06590493).
О препаратах doxecitine и doxribtimine
Смесь пиримидиновых нуклеозидов doxecitine и doxribtimine, продаваемая под торговой маркой Kygevvi, представляет собой комбинированный препарат с фиксированной дозой, применяемый для лечения дефицита тимидинкиназы 2. Он содержит: doxecitine (deoxycytidine) и doxribtimine (thymidine). Наиболее частые побочные эффекты включают диарею, рвоту, повышение уровня печеночных ферментов и боль в животе. Doxecitine/doxribtimine одобрен для медицинского применения в США в ноябре 2025 года.
Doxecitine/doxribtimine показан для лечения дефицита тимидинкиназы 2 у людей, у которых симптомы проявляются в возрасте до двенадцати лет. Хотя точная частота дефицита тимидинкиназы 2 в мире неизвестна, заболевание считается очень редким. В медицинской литературе описано около 120 случаев, хотя это состояние часто может быть недиагностированным.
О компании UCB
UCB (Union Chimique Belge) — многонациональная биофармацевтическая компания со штаб-квартирой в Брюсселе, Бельгия. UCB — международная компания с выручкой 4,178 млрд евро в 2016 году, которая специализируется на исследованиях и разработках, в частности, лекарственных препаратов для лечения эпилепсии, болезни Паркинсона и болезни Крона. Усилия компании сосредоточены на лечении тяжёлых заболеваний, требующих специализированной помощи, в частности, заболеваний центральной нервной системы (ЦНС) (включая эпилепсию), воспалительных заболеваний (включая аллергию) и онкологии.
Каждые 3 года компания вручает премию UCB Award под патронажем Медицинского фонда королевы Елизаветы для содействия исследованиям в области нейронауки. Лауреат этой премии выбирается независимым научным комитетом.
UCB основана 18 января 1928 года бельгийским бизнесменом Эммануэлем Янссеном (Emmanuel Janssen). Первоначально компания специализировалась на промышленных химикатах (была одной из первых компаний, начавших перегонять аммиак из угля), затем в ее состав входило небольшое фармацевтическое подразделение, базирующееся на базе Meurice Laboratories. Сейчас в UCB работает более 8 000 сотрудников.
Источник: https://www.pulmonologyadvisor.com/
Источник: https://www.linkedin.com/
Источник: https://www.ucb.com/
10.11.2025