Одобрение FDA препарата Skyclarys от атаксии Фридрейха меняет правила игры в лечении редких заболеваний
Американская фармацевтическая компания Reata Pharmaceuticals планирует сделать препарат Skyclarys (omaveloxolone, омавелоксолон) доступным ко второму кварталу 2023 года. Лекарство для лечения редкого неврологического расстройства — атаксии Фридрейха (Friedreich’s ataxia) — должно было пройти только один этап клинических исследовваний (КИ) вместо требуемых двух, чтобы сразу же получить одобрение регулирующих органов.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) 28 февраля одобрило Skyclarys (коммерческое название препарата omaveloxolone) компании Reata Pharmaceuticals для лечения атаксии Фридрейха у взрослых и подростков в возрасте 16 лет и старше. Как правило, FDA одобряет препараты только после двух успешных плацебо-контролируемых КИ заключительной фазы.
Одобрение Reata является первым в своем роде, поскольку оно основано только на одном исследовании, которое сосредотачивается на одной и той же группе пациентов с течением времени, а не на новых пациентах, что вообще-то может изменить правила игры для лечения заболеваний, затрагивающих относительно небольшое количество пациентов.
В 2020 году FDA заявило, что имеет недостаточно доказательств, чтобы дать зеленый свет препарату. Reata не проводила другое КИ, сославшись на отсутствие соответствующих условиям КИ участников — очень немногие люди страдают этим заболеванием и еще меньше из них имеют право на участие в исследовании, — но компания предоставила новые данные долгосрочных результатов, отчетливо показывающие, что у пациентов, принимавших препарат, наблюдалось улучшение неврологических функций сравнительно с плацебо, таких как речь, глотание и стояние.
«Одобрение Skyclarys, первой терапии, специально предназначенной для лечения атаксии Фридрейха, является важной вехой для пациентов, страдающих этим заболеванием, а также для их семей и лиц, осуществляющих уход за больными», — заявил генеральный директор Reata Уоррен Хафф (Warren Huff).
Техасская биофармацевтическая компания рассчитывает завершить производство и поставку Skyclarys — своего первого одобренного продукта — ко второму кварталу этого года.
Что такое атаксия Фридрейха?
Атаксия Фридрейха — редкое генетическое заболевание, вызывающее прогрессирующее поражение нервной системы и создающее проблемы с движением, включая трудности при ходьбе, утомляемость, изменения чувствительности и замедленную речь. Это вызвано дефектом гена, унаследованным от обоих родителей. Симптомы часто начинаются в позднем детстве и имеют тенденцию ухудшаться с течением времени. По словам Reata, болезнь «обычно прогрессирует до двигательной инвалидности уже к подростковому или двадцатилетнему возрасту и, в конечном итоге, к смерти».
В настоящее время лекарства нет.

Что такое Skyclarys?
Лечение представляет собой пероральный препарат для приема 1 раз в день, предназначенный в США для лечения атаксии Фридрейха у взрослых и подростков в возрасте 16 лет и старше. Рекомендуемая доза составляет 150 мг в виде трех капсул по 50 мг. Предполагается прием натощак, за час до еды.
Действующее лицо: Билли Данн
Глава нейробиологии FDA покидает Агентство. Билли Данн (Billy Dunn) присоединился к FDA еще в 2005 году и поднялся по служебной лестнице, чтобы в конечном итоге, создать отдел, который он же и возглавил.
В последние годы Данн стал известен как человек, склонный к неоднозначному, и, возможно, не всегда обоснованному риску. Так, он настаивал на одобрении других препаратов для неврологических состояний на основе ограниченных данных, таких как скандальный препарат Aduhelm от Biogen для лечения болезни Альцгеймера в 2021 году и проблематичный препарат Amylyx для лечения БАС в прошлом году. Его участие в решении проблемы Skyclarys, вероятно, и подтолкнуло препарат к одобрению на финишной прямой.
«Он оказал большое влияние на то, как именно должны разрабатываться и внедряться лекарства для ряда серьезных неврологических заболеваний, многие из которых ранее имели лишь ограниченные возможности лечения», — написал 27 февраля в электронном письме персоналу Питер Стейн (Peter Stein), информируя их о немедленном отъезде Данна.
Известие о его уходе, появившееся до того, как было объявлено об одобрении FDA Skyclarys, привело к падению акций Reata на 30%. «Такое падение неудивительно, учитывая почти единодушное мнение экспертов о том, что лекарство Reata не получит ни единого шанса при рассмотрении его любым другим сотрудником, вплоть до директора FDA», — написал аналитик Baird Брайан Скорни (Brian Skorney).
Лечение атаксии Фридрейха в цифрах
5000: число пациентов с диагнозом атаксия Фридрейха в США.
150%: насколько акции Reata подскочили в нерабочее время на фоне новостей об одобрении Skyclarys FDA.
74 000: количество подписавших петицию, созданную Альянсом исследований атаксии Фридрейха (Friedreich’s Ataxia Research Alliance, FARA), призывающей Reata добиваться одобрения лечения, а FDA рассмотреть его достоинства.
$400 млн: прогнозируемые продажи Skyclarys в США к 2030 году, по словам аналитика Jefferies Мори Рэйкрофта (Maury Raycroft).
$425 000: стоимость препарата на одного пациента в год, согласно Рэйкрофту .
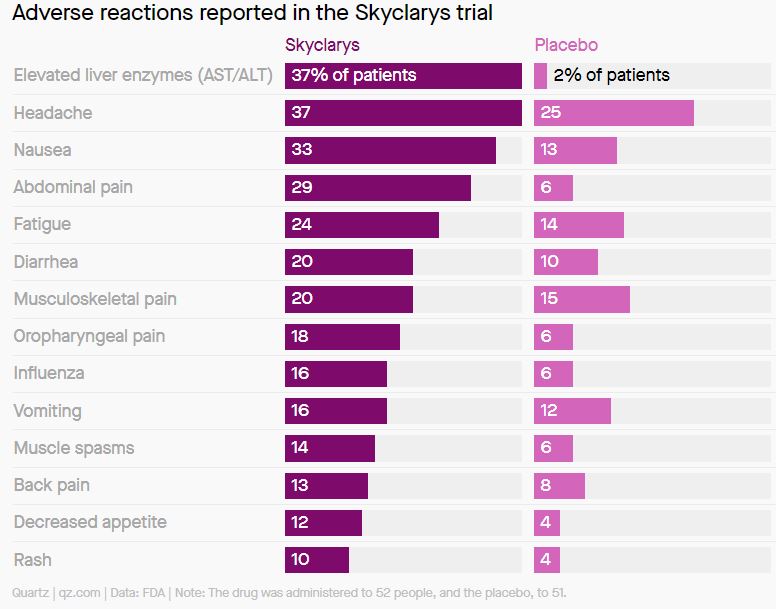
10%: доля пациентов, у которых наблюдались побочные реакции, в основном легкой или средней степени тяжести.
Reata Pharmaceuticals, Inc.
Reata Pharmaceuticals, Inc. — фармацевтическая компания, базирующаяся в Плано, штат Техас. Основанная в 2002 году, Reata занимается, в первую очередь, исследованием экспериментальных пероральных антиоксидантных и противовоспалительных препаратов, которые одновременно активируют антиоксидантный фактор транскрипции Nrf2 и ингибируют провоспалительный фактор транскрипции NF-κB. Антиоксидантные и противовоспалительные соединения bardoxolone methyl и RTA 408 являются ведущими соединениями для КИ в портфолио Reata.
Bardoxolone methyl был одним из первых представителей класса синтетических тритерпеноидов, изученных в клинике. Он был оценен в КИ фазы 1 для рака, исследований фазы 2 и 3 для хронической болезни почек (ХБП), связанной с диабетом 2 типа, и в настоящее время оценивается в КИ фазы 2 для легочной артериальной гипертензии.
Reata также активно занимается открытием низкомолекулярных лекарств, модифицирующих заболевание, которые функционируют путем стабилизации нормальной трехмерной структуры белков-мишеней либо в целом улучшают среду свертывания клетки. Дефекты укладки белков лежат в основе большого числа генетических заболеваний, включая некоторые формы рака, болезнь Альцгеймера и муковисцидоз. Также считается, что дефекты фолдинга белков играют важную роль в развитии ненаследственных форм многих из этих заболеваний.
Источник: https://qz.com/
3.03.2023