Orphalan впервые за 52 года получает одобрение FDA для лекарства от болезни Вильсона
Французской фармкомпании Orphalan, специализирующейся на орфанных заболеваниях, потребовалось целых 11 лет, чтобы получить свое первое одобрение регулятора в США. Но это ничто по сравнению с тем, как долго люди с болезнью Вильсона ждали появления нового лекарства.
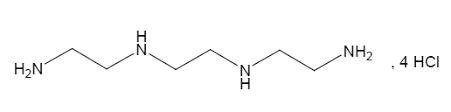
В понедельник Агентство по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило препарат Cuvrior (trientine tetrahydrochloride, Кувриор, тетрагидрохлорид триентина), который стал первым одобренным средством для лечения этого заболевания за 52 года.
Болезнь Вильсона — наследственное заболевание, не позволяющее печени фильтровать медь, вызывая ее токсическое накопление и повреждение органов. Подсчитано, что не менее 10 000 человек в США страдают болезнью Вильсона, и эта цифра составляет только около половины случаев, поскольку недуг зачастую неправильно диагностируют, путая с другим более распространенным типом заболевания печени.
Медь (Cu) участвует в обмене различных белков и ферментов, при совместном употреблении с цинком и витамином С улучшает состояние кожи, помогает сохранить ее эластичность. Медь важна для производства гемоглобина и красных кровяных телец, она способствует усвоению железа, участвует в синтезе меланина.
До появления первого лечения болезни Вильсона пациенты редко доживали до 30 лет. Но ситуация изменилось с введением купримина (пеницилламина) в 1970 году.
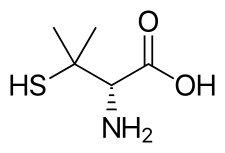
Пеницилламин
Cuvrior действует по тому же механизму, что и пеницилламин, поскольку оба они присоединяются к меди с образованием соединения, способного выводиться из организма. Но прием обоих препаратов может вызывать затруднения, поскольку больные вынуждены пить от 8 до 12 таблеток по несколько раз в день натощак.
«Это по своей природе нестабильное соединение», — сказал в интервью генеральный директор Orphalan Насим Амин. «Мы разработали новую соль, которая действительно стабильна при комнатной температуре. Вы можете взять препарат с собой куда угодно. Просто достаньте его из блистерной упаковки, запейте водой, и готово».
Пациенты могут принимать Cuvrior после того, как они были «обезмеднены» хелатирующими агентами, которые блокируют всасывание меди из желудочно-кишечного тракта. После хелатирования пациент переходит на Cuvrior и цинк для поддержания жизни.
Orphalan планирует запустить продажи и заняться продвижением Cuvrior в США в начале следующего года.
Нужно отметить, что это не первый случай, когда препарат получает официальное одобрение. В 2017 году Cuvrior был одобрен в Европе в качестве препарата второй линии для лечения болезни Вильсона у 30-40% пациентов с непереносимостью пеницилламина.
Известный в Европе как Cuprior, препарат считался более безопасным, но не обладал эффективностью пеницилламина. Когда исследование показало, что он может сравниться по эффективности со своим предшественником, Orphalan решила получать одобрение в США.

Для этой цели компании пришлось разработать собственный тест на медь в сыворотке для измерения ключевого биомаркера исследования.
«Мы довольны не только самим средством, но и потенциалом, который имеет этот анализ», — сказал Амин. «Медицинскому сообществу нужен надежный способ мониторинга этих пациентов. Мы опробовали метод на пациентах, за которыми уже осуществлялось наблюдение. Теперь мы планируем использовать его для пациентов, которым еще только предстоит поставить диагноз».
Для Orphalan получение одобрения от FDA является значимым событием, учитывая, что их средство для лечения спинальной мышечной атрофии потерпело неудачу после шести лет клинических исследований.
Однако конкуренты не дремлют: Alexion, подразделение AstraZeneca по лечению редких заболеваний, получило статус орфанного препарата в Европе и США для своей разработки ALXN1840. FDA также присвоило ему статус ускоренного рассмотрения. Результаты испытания фазы 3 в сентябре прошлого года показали, что оно достигло своей основной конечной точки.
FDA также присвоило статус ускоренного рассмотрения двум генным препаратам для лечения болезни Вильсона: VTX-801, созданного Pfizer и Vivet Therapeutics, и UX701, разработанного Ultragenyx. Первичные результаты этих испытаний будут оглашены в 2023 и 2026 годах соответственно.
Источник: https://www.fiercepharma.com/
4.05.2022