Остановка Big Pharma клинических исследований новых лекарств в РФ: к чему она может привести?
В связи с новой геополитической реальностью, проявившейся в начале 2022 года, компании Big Pharma массово останавливают клинические исследования своих новых лекарственных препаратов в Российской Федерации. В перспективе ближайшего десятилетия это способно привести к нехватке в нашей стране высокоэффективных инновационных лекарств следующих поколений, в том числе способных противостоять новым опасным формам инфекционных и опухолевых патогенов, резистентных к имеющемуся арсеналу медикаментов и стандартов лечения. В этот напряженный момент требуется глубокий анализ актуальной ситуации и тенденций ее развития в сфере обеспечения населения России современными лекарствами.

Отечественный фармрынок показывает в последние годы хорошие темпы роста, однако является весьма импортозависимым: доля лекарств импортного происхождения составила в 2022 году 55,0% в рублях и 32,7% в упаковках, а объем импорта фармпрепаратов в РФ вырос почти до $21 млрд. Не менее тревожным является то, что фармрынок РФ остается преимущественно дженериковым, причем по этому показателю в последние годы наблюдается негативная динамика. При этом практически единственным значимым источником современных инновационных лекарственных средств в нашей стране является импорт из недружественных стран.
На этом фоне весьма тревожными стали известия о том, что после начала специальной военной операции в феврале 2022 года компании Big Pharma фактически прекратили клинические испытания своих новых препаратов в нашей стране. В соответствии с действующим законодательством, это означает формальную невозможность импорта и обращения этих препаратов в РФ.
В этой непростой ситуации необходимо оценить количественные параметры происходящих изменений, а также их потенциальные последствия. Для этого мы проанализировали лекарственные препараты, одобренные регуляторными ведомствами США, ЕС и Японии в период с 2016 по 2023 год, в контексте их регистрационной истории в РФ. Целью этого исследования является выработка действенных мер, которые позволят обеспечить суверенитет нашей страны в сфере лекарственного обеспечения. Ниже представлены методология и ключевые результаты этого анализа.
Источники информации и методология
В качестве источника информации по лекарственным препаратам (далее ЛП), одобренным регуляторными ведомствами США, ЕС и Японии, была использована база данных KEGG DRUG – авторитетный информационный ресурс по ЛП, созданный и поддерживаемый двумя ведущими научными центрами Японии – Киотским и Токийским университетами. Были выявлены 439 ЛП на основе химических или биологических соединений, за исключением вакцин, зарегистрированных в указанных странах в период с 2016 по 2023 год.
Источниками данных по зарегистрированным в РФ ЛП и клиническим исследованиям стали соответствующие государственные реестры. В них был осуществлен поиск по каждому из вышеуказанных 439 ЛП (по МНН). Было выявлено 93 ЛП, зарегистрированных в РФ с 1 января 2016 года по 31 декабря 2023 года, а также 185 ЛП, для которых в РФ в разное время (с 2011 по 2023 год) были инициированы первые клинические исследования третьей фазы. В качестве источника информации по срокам патентной защиты лекарственных средств был использован глобальный информационный сервис Pharsight.
На основании полученных данных были проведены аналитические исследования по выявлению закономерностей и количественных маркеров, позволяющих прогнозировать перспективы появления новых ЛП зарубежной разработки в РФ. Далее представлены их основные результаты.

Регистрационная активность в РФ зарубежных производителей в 2016—2023 годах.
В табл. 1 приведены количественные данные по регистрационной активности производителей из США, ЕС и Японии в РФ в анализируемый период. Всего было выявлено 439 ЛП, впервые зарегистрированных в зарубежных странах в 2016-2023 годах. Их количество неравномерно распределено по годам – от 23 в 2016 году до 71 в 2020 году. Из этого списка в РФ было зарегистрировано 93 препарата (21% от общего числа).
Во второй строке представлены количества препаратов из числа впервые одобренных в США, ЕС или Японии в указанном году, зарегистрированных в РФ в любое последующее время. Например, в 2020 году в указанных странах всего был зарегистрирован 71 ЛП, и 13 из них были затем зарегистрированы в РФ в период с 2020 по 2023 год. Заметно значимое падение числа зарегистрированных ЛП, впервые выведенных на мировой рынок в 2022-2023 годах, что, впрочем, может объясняться сдвигом в регистрационных циклах.
Данные из третьей строки таблицы подтверждают тот факт, что зарубежные компании фактически прекратили примерно с марта 2022 года клинические исследования своих новых ЛП: всего в 2022 и 2023 годах было начато восемь и одно клиническое исследование третьей фазы соответственно, тогда как в предшествующие шесть лет ежегодно инициировалось от 16 до 25 исследований.
Попытаемся ответить на вопрос: означает ли эта приостановка лишь временную задержку на пути новых ЛП на рынок РФ или она может полностью исключить их появление в нашей стране в обозримом будущем?
Ключевые параметры, выявленные или рассчитанные в проведенном исследовании, сведены на рис. 1. Он схематически показывает жизненный цикл зарубежного инновационного ЛП в контексте перспектив его регистрации в РФ.
Ключевой точкой отсчета является дата первой мировой регистрации ЛП регуляторным ведомством США, ЕС или Японии. Эта точка находится в неразрывной взаимосвязи с тремя другими важнейшими временными маркерами: 1) датой начала первого клинического исследования третьей фазы в РФ, 2) датой регистрации в РФ, 3) сроком истечения патентной защиты. На рис. 1 представлены распределения периодов времени, прошедшего от даты первой регистрации ЛП в США, ЕС или Японии до трех указанных маркеров. Также указаны соответствующие статистические параметры.
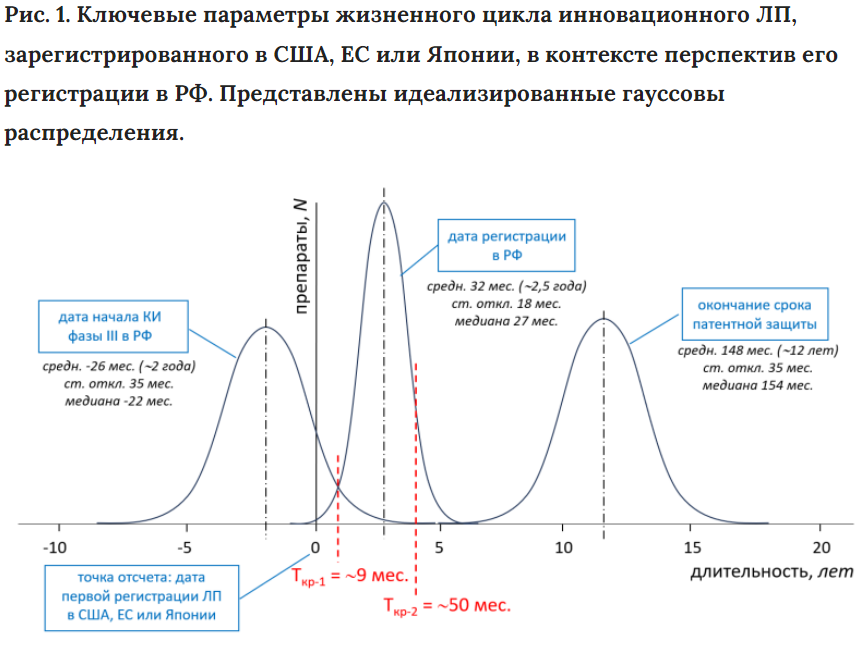
Анализ представленной схемы позволяет определить следующий ряд ключевых параметров, которые могут быть полезными при оценке перспектив регистрации в РФ инновационного ЛП, впервые одобренного в США, ЕС или Японии.
- Временной диапазон между датами первой мировой регистрации ЛП и регистрации в РФ составляет 2,5±1,5 года.
- Период времени от даты начала третьей фазы клинических исследований в РФ до даты регистрации в РФ составляет 4,5±2,5 года.
- Примерно для 80% ЛП клинические исследования третьей фазы начинаются в РФ еще до момента их регистрации в США, ЕС или Японии. В среднем эти исследования начинаются за 2±3 года до первой мировой регистрации.
- Средняя длительность периода эксклюзивного присутствия ЛП на мировом рынке (период времени между первым одобрением и окончанием срока патентной защиты) составляет примерно 12 лет, а на рынке РФ – 9,5 года.
- При помощи статистических методов были также определены следующие критические точки: Tкр-1= 9 мес. – максимально допустимый период времени между датой регистрации ЛП в США, ЕС или Японии и датой начала первого клинического исследования третьей фазы в РФ; Tкр-2 = 50 мес. (~4 года) – максимально допустимый период времени между датами зарубежной и российской регистрации ЛП. При превышении указанных критических величин вероятность дальнейшей регистрации ЛП в РФ выходит за пределы стандартного отклонения, то есть его появление на рынке РФ становится маловероятным. Наибольшей прогностической значимостью в контексте настоящего исследования обладает точка Tкр-1.
В проведенном исследовании имеется ряд ограничений, анализ которых выходит за рамки настоящей публикации. Тем не менее представленные параметры могут служить полезными практическими ориентирами при оценке перспектив появления зарубежных инновационных ЛП в РФ.
Потенциальные последствия для здравоохранения РФ.
Следует понять, с какими потенциальными последствиями столкнутся фармрынок и система здравоохранения РФ в случае, если указанная тенденция к остановке клинических исследований сохранится. Применяя определенные выше критерии, мы можем отобрать инновационные зарубежные препараты, которые с высокой вероятностью не появятся в ближайшие годы на рынке РФ. В качестве примеров в табл. 2 представлены препараты, одобренные в США в 2022-2023 годах, которые уже вышли за пределы критерия Tкр-1 (~9 мес.) на начало января 2024 года, поскольку были зарегистрированы в США ранее апреля 2023 года. Особенностью всех этих ЛП является то, что они действуют на резистентные мутантные формы инфекционных или опухолевых патогенов.
Табл. 2. Примеры инновационных ЛП, одобренных в США ранее апреля 2023 года, не удовлетворяющие критерию Tкр-1.

Этот список можно дополнить десятками других высокоэффективных инновационных препаратов, которые с высокой вероятностью утратили шансы для использования в ближайшие годы, а возможно, и навсегда для нужд здравоохранения РФ.
Можно резюмировать, что остановка клинических исследований новых ЛП, одобренных в США, ЕС или Японии в 2022-2023 годах, способна привести и уже приводит к серьезным негативным последствиям для здравоохранения РФ. Наибольшую тревогу вызывает потенциальная нехватка в нашей стране в ближне- и среднесрочной перспективе высокоэффективных современных лекарств, способных противостоять новым опасным формам инфекционных и опухолевых патогенов, резистентных к имеющемуся в РФ арсеналу медикаментов и стандартов лечения.
В этой непростой ситуации важнейшей и безотлагательной задачей отечественной науки и индустрии является создание собственных инновационных препаратов следующих поколений, не уступающих лучшим мировым разработкам. Для этого имеются все возможности. Одним из вариантов решения этой задачи, основанным на опыте ведущих мировых разработчиков, является создание инновационных лекарственных аналогов.
Авторы: Константин Валерьевич Балакин, д. х. н., в. н. с. Московского физико-технического института;
Источник: https://gxpnews.net/
22.01.2024