Отечественная фарминдустрия «забуксовала» на дженериках
18 июня 2025 г. в рамках форума «Лекарственная безопасность» на площадке ПМЭФ прошла стратегическая сессия «Технологии, опережающие время. Инновационный путь развития фармотрасли в России» с участием заместителя министра промышленности и торговли РФ Екатерины Приезжевой, заместителя министра здравоохранения Сергея Глаголева, заместителя руководителя ФАС Тимофея Нижегородцева, а также руководителей ведущих российских фармкомпаний. Модераторами дискуссии выступили председатель правления Ассоциации фармацевтических производителей ЕАЭС Алексей Кедрин и советник генерального директора АНО «Инновационный инжиниринговый центр» Олег Лавров.

Развитие отечественного производства инновационных лекарств и локализации отрасли в рамках государственных стратегий требует координации усилий всех участников сферы здравоохранения. При поддержке и деятельном участии фонда «Иннопрактика» удалось наладить взаимодействие между Минпромторгом России, Минздравом России и Министерством образования РФ и создать Координационный совет, объединяющий представителей бизнеса, регуляторов и институты развития. Планируется, что Координационный совет будет формировать список актуальных биомишеней и технологий, вокруг которых надо концентрировать ресурсы всех участников. Главная задача такого совета — синхронизировать действия всех сторон для преодоления межведомственных колодцев и той самой «долины смерти» в инновационном цикле, чтобы ускорить внедрение прорывных технологий в практику здравоохранения.
Анализ текущей ситуации показывает, что отечественная фарминдустрия застряла на модели производства дженериков. Период активного импортозамещения завершился в 2018-2019 годах, уже тогда были исчерпаны возможности развития в этом направлении.
«Если на аптечном рынке еще наблюдается рост доли отечественных производителей в денежном выражении, что обусловлено уходом иностранных компаний и снижением их маркетинговых затрат, то на рынке госзакупок фиксируется устойчивая тенденция к снижению доли российских производителей, что свидетельствует о деградации отрасли. Клинические испытания также демонстрируют кратное сокращение инновационных разработок. С 2022 года значительно уменьшилось количество 1-3 фаз, ранее в основном финансировавшихся иностранными компаниями. В настоящее время в клинике находятся преимущественно дженерики и биоподобные препараты», — приводит статистику Андрей Иващенко, руководитель комитета инновационной фармацевтики ассоциации «Национальные чемпионы», председатель совета директоров ГК «ХимРар».
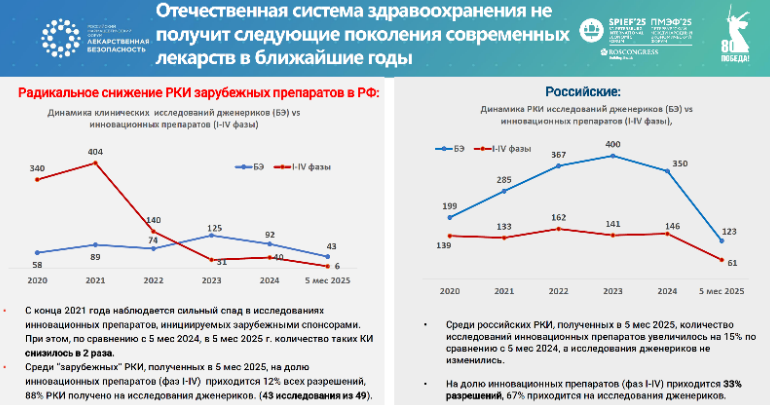
О технологическом суверенитете и технологическом лидерстве в данном случае говорить не приходится. Даже освоение производства субстанций не решает ключевой проблемы – отсутствия собственных разработок следующих поколений лекарственных препаратов в нужных объёмах, более того, есть риск повторения сценария автомобильного рынка, где после ухода западных производителей доминирующим игроком стал китайский автопром.
В своем выступлении Андрей Иващенко также обратил внимание на мировые тенденции:
«FDA регистрирует около 50 новых молекулярных и биологических препаратов ежегодно, из которых половина — дорогостоящие орфанные препараты, а вторая половина — прорывные разработки с новыми методами лечения. За последние четыре года в мире появилось около сотни инновационных препаратов и технологий, которые недоступны в России. Если мы не ничего не предпримем, чтобы запустить собственные инновации, а отрасль продолжит жить в парадигме дженерикового импортозамещения, то через 3−5 лет нам придется регистрировать западные инновационные препараты следующих поколений без клинических испытаний в России, поскольку пациентов надо будет лечить от резистентных форм болезней, которые разовьются к тому времени на текущих стандартах».
Особо был отмечен опыт Китая: в 2013–2014 годах доля китайских инноваций составляла 4% от мировых, к настоящему времени этот показатель достиг 30%. В клинике находится более 4000 проектов, более 2000 из них – первые в своем классе препараты и технологии, около 1000 – следующие в классе разработки. Эти цифры догнали по объему исследований, которые проводятся в США, то есть КНР — это уже сравнимый с западным рынком источник инноваций для мировой системы здравоохранения.
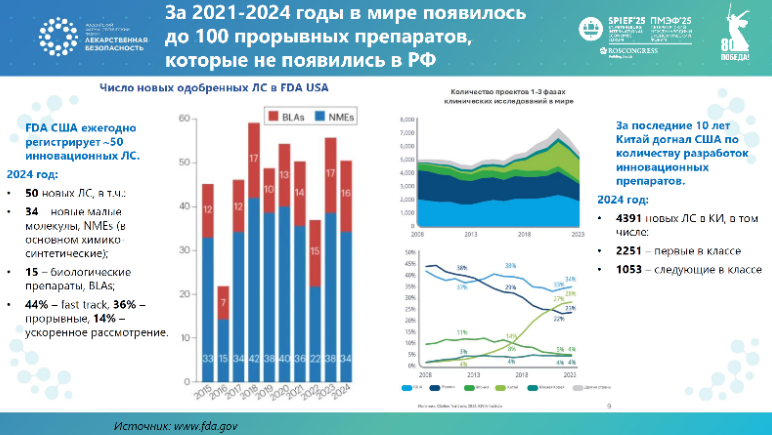
Андрей Иващенко отметил, что спад биотехнологического сектора в США и бурный рост разработок в Китае открывает новые возможности для российской фарминдустрии:
«Это создает реальные возможности для приобретения перспективных разработок путем передачи прав в Россию на разработки, приостановленные на первой или второй фазах клинических исследований в США через дружественные страны, включая арабские государства; а также из Китая, где из-за введённых на американском рынке ограничений для китайских компаний возникли значительные предпосылки для трансфера перспективных разработок в Россию и их совместного выведения на наш рынок».
За счет такого сотрудничества можно было значительно увеличить приток прорывных препаратов и технологий, которые в мире появились, а в России нет. В этом случае фармотрасли необходима институциональная поддержка на уровне государства для координации взаимодействия в области биотеха со странами БРИКС.
Моделирование, связанное с инновационным импортозамещением, показывает, что на запуск такого процесса потребуется консолидировать около 100 миллиардов рублей. При этом вложения окупятся примерно за 8 лет. Если рассматривать экономику в целом и ставить задачу выпуска порядка 100 препаратов — половина биологического происхождения, половина химического — такие цифры вполне реалистичны. Для отрасли и для объемов финансирования, которые сегодня направляются на инновации через профильные ведомства, эти суммы вполне подъемные. Таким образом, внутренний спрос не только создает рынок, но и стимулирует инновационное развитие, обеспечивая возврат инвестиций и формируя устойчивый экономический рост.
Заместитель руководителя ФАС России Тимофей Нижегородцев отметил, что иинновации — это прежде всего продукт здоровой конкуренции и что главной задачей сейчас становится создание условий, при которых разработка новых препаратов станет экономически выгодной для производителей, а лекарственные средства будут доступны для населения.
Среди необходимых мер поддержки участники выделили так называемое предварительное рассмотрение — согласование инновационных проектов с регулятором, чтобы при получении ожидаемых результатов, они были востребованы или по крайней мере совпадали с согласованными предварительно приоритетами.
Система компенсации «плата за успех», о которой говорила замминистра Минпромторга России Екатерина Приезжева, может быть дополнена путем рассмотрения условной регистрации после второй фазы, компенсации затрат на первую и вторую фазы при получении условного регистрационного удостоверения и смещения акцента в сторону научных разработок.
«Мы трансформировали механизмы регистрации, введя условную регистрацию, определив критерии социально значимых лекарственных препаратов, которые должны погружаться и в механизмы отбора лекарственных средств для включения в перечень ЖНВЛП, для протяжки их в клинические рекомендации», — заявил Сергей Глаголев, замминистра Минздрава России.
Чтобы эти механизмы начали эффективно работать в интересах пациентов и врачей и быстрее внедрялись в медицинскую практику, прорывные препараты, получившие условную регистрацию, должны попадать в клинические рекомендации, а для этого нужно чтобы пересмотр и актуализация рекомендаций проводились чаще, чем это происходит сейчас, либо должны появиться экспериментальные клинические рекомендации для таких препаратов и методов лечения. Кроме того, как справедливо отметил Тимофей Нижегородцев, процесс включения препаратов в клинические рекомендации должен стать более прозрачным и открытым и учитывать в первую очередь клинические и терапевтические аспекты применения инновационных лекарств.
Видеозапись сессии доступна на сайте ПМЭФ’25 по ссылке: https://forumspb.com/programme/drug-security-forum/137102/
4.07.2025