Болезнь Альцгеймера начинается с нарушения аутофагии
Исследователи из США и Германии открыли, что патологическое накопление бета-амилоида (Aβ) не является инициирующим событием патогенеза болезни Альцгеймера. На самом деле агрегацию Aβ запускают недостаточное закисление аутофагосом и образование характерных мембранных структур вокруг ядра, которые авторы назвали «ядовитыми цветами» (PANTHOS).
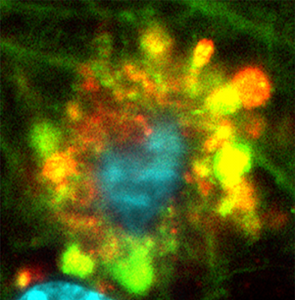
Цветкообразные образования аутофагических вакуолей в нейронах мыши с болезнью Альцгеймера
Источник: Springer-Nature
Болезнь Альцгеймера — самое распространенное нейродегенеративное расстройство. Согласно прогнозам, в ближайшие десятилетия число заболевших может увеличиться в несколько раз, что стимулирует активные поиски новой терапии. В сложной картине патогенеза болезни Альцгеймера наиболее важными считают появление и накопление патогенных форм тау-белка и бета-амилоида (Aβ).

В статье, опубликованной коллективом американских и немецких ученых в журнале Nature Neuroscience, описан принципиально новый механизм начала патологических изменений бета-амилоида, который связан с системой аутофагосом и аутолизосом внутри клеток.
Аутофагия — это разрушение отработавших ресурс или поврежденных белков и органелл в лизосомах. При макроаутофагии двойная мембрана обволакивает часть цитоплазмы с образованием аутофагосов, которые после слияния с лизосомами созревают до аутолизосом. Лизосомы приносят с собой катепсины, другие кислые гидролазы и vATPase (АТФазу вакуолярного типа), которая закисляет аутолизосому и активирует гидролазы.

Исследователи получили трансгенных животных, экспрессирующих в нейронах флуоресцентный химерный белок mRFP-eGFP-LC3, который избирательно метит аутофагосомы и аутолизосомы. По его флуоресцентному сигналу авторы оценивали интенсивность аутофагии и изменения внутриклеточного pH. Для этого они использовали мультиплексную конфокальную визуализацию и корреляционную электронно-оптическую микроскопию (CLEM). Трансгенных мышей скрещивали с модельными мышами с болезнью Альцгеймера для изучения связи ее начала с аутофагией.
В нейронах всех животных были отмечены нарушения аутофагии (в популяции чувствительных нейронов), в том числе, снижение активности vATPase лизосом, а также накопление APP и бета-амилоида в недостаточно закисленных аутолизосомах. Авторы отмечают, что нарушения pH в аутолизосомах заметны до начала патологических процессов, связанных с бета-амилоидом.
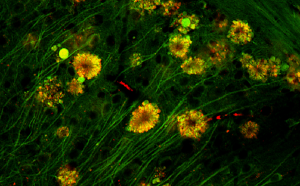
«Ядовитые цветы» в мозгу мыши
Источник: Springer-Nature
Однако наиболее поразительным стало описание так называемых «ядовитых цветов» (poisonous anthos, PANTHOS), см. предоставленные фото. Ассоциированные с аутофагией вакуоли поврежденных нейронов скапливаются внутри мембранных образований (blebs) и вспучивают внешнюю мембрану клетки. Радиально сходящиеся к ядру и ярко флуоресцирующие из-за обилия меченого бета-амилоида, эти структуры напоминают лепестки цветка.
Новая статья претендует на пересмотр современных представлений о патогенезе болезни Альцгеймера, прежде всего, популярной и устоявшейся гипотезы амилоидного каскада. Согласно ей, «спусковым крючком» заболевания является именно образование агрегатов бета-амилоида вне клеток. Авторы новой статьи отводят роль инициатора патогенеза нарушениям работы лизосом внутри нейронов.
«Из нашей работы следует, что основой для новых методов терапии должно стать обращение дисфункции лизосом и восстановление баланса кислотности внутри нейронов мозга», — говорит Ральф Никсон, профессор кафедры психиатрии и кафедры клеточной биологии Медицинского центра Нью-Йоркского университета имени Лангона. Ученые также отметили, что уже работают над таргетирующими патологию аутофагосом подходами к лечению болезни Альцгеймера.
Цитируется по:
Lee J.H., et al. Faulty autolysosome acidification in Alzheimer’s disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques // Nature Neuroscience (2022), published online 02 June 2022. DOI: 10.1038/s41593-022-01084-8.
Источник: https://pcr.news/
7.06.2022