Открыты новые молекулярные механизмы прогрессии глиомы
На животной модели обнаружены новые молекулярные механизмы прогрессии диффузной срединной глиомы и экспериментально подтвержден вклад аминокислотного метаболизма в развитие патологии. Так, обычное диетическое ограничение метионина влияет на эпигенетические механизмы и в полтора раза продлевает выживаемость модельных мышей.
Diffuse Midline Glioma, DMG
Исследователи из Медицинской школы университета Питтсбурга (США) совместно с учеными из Канады, Чехии и Китая открыли новые молекулярные механизмы прогрессии диффузной срединной глиомы — а именно ее зависимость от аминокислоты метионина.
Диффузная срединная глиома (Diffuse Midline Glioma, DMG) — новый подкласс глиом высокой степени злокачественности. Ее наиболее опасная и агрессивная форма, одна из основных причин смертности от онкозаболеваний мозга у детей — диффузная внутренняя глиома моста (Diffuse Intrinsic Pontine Glioma, DIPG). Анатомическое расположение DIPG исключает хирургическое лечение, а химиотерапевтических препаратов, способных проникать через гематоэнцефалический барьер, существует немного. Стандартом лечения DIPG на сегодняшний день является лучевая терапия, но она лишь временно улучшает состояние пациента.
Diffuse Intrinsic Pontine Glioma, DIPG
Среди важных факторов онкогенеза DIPG описана мутация в гистоне H3, приводящая к замене лизина в 27-м положении на метионин (H3K27M): она встречается более чем в 80% опухолей этого типа. Мутантный гистон H3K27M ингибирует репрессивный белковый комплекс PRC2 путем взаимодействия с его субъединицей EZH2, тем самым значительно снижая уровень триметилирования гистонов (H3K27me3). Сопутствующее увеличение ацетилирования H3K27 (H3K27Ac) усиливает транскрипцию ряда онкогенных белков и активирует некоторые сигнальные пути, определяющие метаболизм опухолевых клеток.
Помимо мутаций в гистоновых белках, причиной развития DIPG, как и других опухолей головного мозга, могут быть значительные изменения эпигенома (совокупности эпигенетических модификаций). Например, мутации в генах, кодирующих ферменты цикла трикарбоновых кислот — а это центр пересечения множества метаболических путей в организме — часто способствуют развитию и прогрессированию рака, нарушая клеточный метаболизм и изменяя эпигенетический ландшафт. Объединение этих результатов может дать новое представление о природе DIPG и возможностях разработки таргетной терапии.
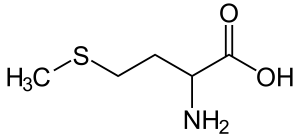
Метионин
Авторы нового исследования предположили, что DIPG может проявлять метаболическую зависимость от аминокислотного состава питания. Чтобы смоделировать влияние известных мутаций при DIPG на пролиферирацию опухолевых клеток, в частности на их метаболизм, они провели трансформацию OLIG2-позитивных нейральных прогениторных клеток (OLIG2+-НПК). В эти клетки ввели три мутации: H3K27M; мутацию, ведущую к гиперэкспрессии рецептора тромбоцитарного фактора роста (PDGFRA); замену в структуре антионкогена — белка p53 (TP53 R237H). Клетки с такими мутациями назвали H3K27MPP. C помощью инъекций их ввели мышам в ствол головного мозга. Для контроля использовали мышей, которым были введены похожие клетки, но содержащие гистон H3 дикого типа (H3WTPP), а также животных, которым были введены OLIG2+-НПК без каких-либо мутаций. Через две недели МРТ подтвердила развитие опухоли и ее гистологическое сходство с DIPG у опытной группы.
Чтобы проанализировать конкретные молекулярные механизмы, управляющие трансформацией клеток H3K27MPP, был проведен транскриптомный анализ, по результатам которого ученые отметили увеличение экспрессии ряда транскрипционных факторов в мутантной линии. Дополнительный анализ обогащения по функциональной принадлежности генов различных метаболических путей показал значительное обогащение группы генов метионинового и цистеинового метаболизма. Особое внимание исследователи уделили гену метионинаденозилтрансферазы (MAT2A).
Хотя метионин является незаменимой аминокислотой, ограничение его содержания в рационе увеличивает продолжительность жизни некоторых организмов. Метионин — неотъемлемая часть одноуглеродного метаболизма, то есть переноса одноуглеродных групп в серии ферментативно связанных реакций. В центре одноуглеродного метаболизма находятся два связанных метаболических цикла: цикл фолиевой кислоты и цикл метионина. MAT2A превращает метионин в S-аденозилметионин (SAM), который является донором метила для многочисленных реакций. Использование SAM в качестве субстрата в реакции с MAT2A дает продукт S-аденозилгомоцистеин (SAH), который затем превращается в гомоцистеин и в итоге обратно в метионин. SAH также может участвовать в пути транссульфирования с образованием других серосодержащих аминокислот.
Дальнейший эксперимент с нокдауном гена MAT2A в линии H3K27MPP показал замедление роста мутантных клеток, что предполагает метаболическую уязвимость DIPG. Ингибирование MAT2A или истощение запасов метионина изменяет уровень эпигенетических модификаций. Так, авторы сообщают, что ингибирование MAT2A приводит к истощению гистоновой метки H3K36me3 (эта метильная метка преимущественно расположена в центрах и на 3′-конце активных генов).
Чтобы определить, повлияет ли потеря MAT2A или ограничение метионина, поступающего с пищей, на выживаемость in vivo, ученые имплантировали клетки H3K27MPP мышам, которые получали контрольный корм с 0,86% метионина или корм с ограничением метионина до 0,12%. У мышей, «соблюдающих» диету, общая выживаемость выросла с 38 до 57 дней. Также у них увеличилась экспрессия MAT2A, поскольку более низкое содержание метионина повышает его стабильность и сплайсинг.
Таким образом, авторы обосновывают стратегию, в соответствии с которой воздействие на метаболизм, например, через диетическое ограничение метионина, может стать новым подходом к терапии опухолей головного мозга у детей.
Цитируется по:
Golbourn B. J. et al. Loss of MAT2A compromises methionine metabolism and represents a vulnerability in H3K27M mutant glioma by modulating the epigenome // Nature Cancer. – 2022. DOI 10.1038/s43018-022-00348-3.
Источник: https://pcr.news/
20.04.2022