FDA готово одобрить новый сомнительный препарат для лечения БАС
Производитель лекарств Amylyx просит FDA одобрить новый препарат для лечения БАС, смертельного нейродегенеративного заболевания. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, вероятно, одобрит спорный новый препарат от БАС к концу месяца. Боковой амиотрофический склероз (БАС, Amyotrophic lateral sclerosis, ALS), часто упоминаемый как «болезнь Лу Герига,» представляет собой прогрессирующее нейродегенеративное заболевание, поражающее нервные клетки головного и спинного мозга. Прогрессирующая дегенерация двигательных нейронов в конечном итоге приводит к их смерти.

Но до сих пор неясно, действительно ли препарат под названием AMX0035 помогает людям с БАС, редким и смертельным неврологическим расстройством, приводящим больных к тому, что человек не может ходить, говорить, глотать и дышать.
В марте Консультативный комитет FDA по лекарствам для периферической и центральной нервной системы пришел к выводу, что исследование 137 пациентов с БАС не предоставило «существенных доказательств» эффективности AMX0035. В сентябре тот же комитет вновь собрался и на этот раз все же рекомендовал одобрить препарат после получения ряда писем от пациентов и членов их семей с соответствующими просьбами.

FDA, обычно следующее рекомендациям Консультативного комитета, заявило, что примет решение к 29 сентября.
Одобрение более вероятно сейчас, чем несколько десятилетий назад, говорит Холли Фернандес Линч (Holly Fernandez Lynch), профессор кафедры медицинской этики и политики в области здравоохранения Пенсильванского университета. «В FDA склонны принимать более слабые доказательства», — считает она.

Два старых продукта, один новый препарат
AMX0035 представляет собой комбинацию двух известных продуктов. Один из них — пищевая добавка taurursodiol (таурурсодиол), ее можно приобрести в Интернете. Другой — рецептурный препарат sodium phenylbutyrate (фенилбутират натрия), использующийся для лечения редкого типа метаболического расстройства.
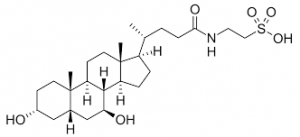
Таурурсодиол
Комбинация предназначена для замедления прогрессирования БАС, который постепенно разрушает клетки головного и спинного мозга, контролирующие произвольное движение мышц.
AMX0035 разработан Amylyx — фармацевтической компанией, базирующейся в Кембридже, штат Массачусетс, основанной в 2013 году двумя выпускниками Университета Брауна.
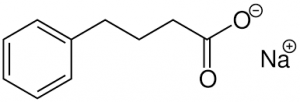
Фенилбутират натрия
Amylyx запросила у FDA одобрение своего препарата на основании одного клинического исследования 137 пациентов с БАС. Результаты показали, что AMX0035 может продлить жизнь пациентов на несколько месяцев.
Но на публичном собрании в марте большинство экспертов консультативного комитета FDA заявили, что их не убедило исследование под названием Centaur. «У Centaur есть много особенностей, которые ограничивают его убедительность», — сказал доктор Г. Калеб Александер (G. Caleb Alexander), эпидемиолог из Университета Джона Хопкинса. «Заявитель не представил веских доказательств», — утверждает доктор Брайан Трейнор (Bryan Traynor), невролог из Национального института старения. «Данные не так убедительны, как мы надеялись», — считает доктор Лиана Апостолова (Liana Apostolova), эксперт по болезни Альцгеймера в Университете Индианы.
Исследование было «проблемным», сказал доктор Кеннет Х. Фишбек (Kenneth H. Fischbeck), исследователь нейрогенетики в Национальном институте здравоохранения. Он «не достиг порога», говорит доктор Томас Дж. Монтин (Thomas J. Montine), патологоанатом из Стэнфордского университета. «Это исследование само по себе не подтверждает, что этот препарат эффективен при лечении БАС», — высказался доктор Роберт С. Александер (Robert C. Alexander), главный научный сотрудник Инициативы по предотвращению болезни Альцгеймера, возглавляемой Институтом болезни Альцгеймера Banner.

Все шестеро членов комитета проголосовали против, когда их спросили, была ли доказана эффективность препарата. Четыре других члена комитета проголосовали за.
Совет консультантам
Как правило, такой ответ был бы концом, по крайней мере, до тех пор, пока Amylyx не была готова представить данные гораздо более крупного исследования, которое уже началось. Но после мартовской встречи пациенты с БАС и члены их семей вышли в Интернет.
«В офис уполномоченного FDA были отправлены тысячи электронных писем», — говорит Нил Такур (Neil Thakur), руководитель миссии Ассоциации ALS, помогавшей финансировать исследование Amylyx. «Было более 1100 комментариев, отправленных непосредственно самому консультативному комитету, кроме того, предпринимались постоянные усилия со стороны руководителей клинических исследований БАС».
По словам Такура, у небольшого клинического исследования действительно есть недостатки, но Консультативный комитет должен был не замечать их, когда он впервые рассматривал доказательства весной. «Они просили, чтобы это лекарство соответствовало тем же стандартам, что и любое лекарство от любого заболевания, которое не является смертельным и имеет множество эффективных методов лечения», — говорит он.
В настоящее время пациентам с БАС предлагаются варианты лечения, состоящие всего из двух препаратов: эдаравон и рилузол. И даже при таком медикаментозном лечении они обычно умирают в течение двух-пяти лет после постановки диагноза.
От «нет» к «да»
Кампания пациентов с БАС, похоже, оказала влияние на некоторых должностных лиц в FDA. В начале этого месяца Агентство предприняло необычный шаг, повторно созвав свой Консультативный комитет для пересмотра препарата Amylyx. И на этот раз FDA призвало членов комитета взглянуть на ситуацию с другой точки зрения, говорит Такур. «Комитету было ясно, что их просят принять решение с учетом доступных методов лечения и потребностей сообщества больных БАС», — говорит он.
Комитет также получил некоторые дополнительные данные о пациентах, участвовавших в исследовании Amylyx, и данные исследования пациентов с болезнью Альцгеймера, принимавших AMX0035.
Когда Комитет провел свое второе публичное собрание по препарату, к ним обратился доктор Билли Данн (Billy Dunn), руководитель Управления неврологии FDA. Он призвал членов Комитета рассмотреть тяжелое положение пациентов с БАС и предположил, что его Агентство готово одобрить препарат. «Для серьезных недугов, таких как БАС и многие другие неврологические заболевания, действует максимальная степень гибкости регулирования», — сказал он.
FDA даже пересмотрело свой вопрос комитету. Вместо того, чтобы спросить, было ли лекарство эффективным, они просто спросили, следует ли его одобрить. После прослушивания — вместо шести голосов «против», семь из девяти членов комитета решили проголосовать «за».
Эхо Адухельма?
Положительные результаты голосования вызвали подозрения Фернандес Линч (Fernandez Lynch), специалиста по биоэтике из UPenn. «Явно имело место манипулирование Консультативным комитетом, чтобы он проголосовал по-другому», — говорит она, — «Они опасались, что могут принять неправильное решение, если порекомендуют FDA не одобрять этот продукт. Но никто, насколько мне известно, не сказал, что этот препарат соответствует стандарту существенных доказательств».
Стандарт существенных доказательств также был под вопросом, когда FDA рассматривало спорный препарат для лечения болезни Альцгеймера Aduhelm. FDA одобрило этот препарат в прошлом году, несмотря на то, что подавляющим большинством голосов консультативного комитета было решено, что стандарт не был соблюден.
По словам Линч, если AMX0035 будет одобрен, это может стать тревожным сигналом для фармацевтических компаний.
«Сообщение компаниям состоит в том, что вам вовсе не нужно доказывать, что ваше лекарство работает», — говорит она, — «Вам достаточно минимальных усилий, чтобы показать, что оно может сработать».
Источник: https://www.npr.org/
22.09.2022