Препарат Balversa от рака мочевого пузыря компании Johnson & Johnson получил полное одобрение FDA
Пероральный ингибитор киназы FGFR Balversa, первоначально получивший статус FDA Breakthrough Therapy Designation еще в марте 2018 года, теперь полностью разрешен для использования у взрослых с местно-распространенной или метастатической уротелиальной карциномой с чувствительными генетическими изменениями FGFR3, у которых заболевание прогрессировало во время, либо после, по крайней мере, одной линии предшествующей терапии.

На долю уротелиальной карциномы приходится примерно 90% случаев рака мочевого пузыря, и до 20% пациентов с диагнозом метастатической уротелиальной карциномы имеют генетические изменения FGFR3.
Напомним, что в апреле 2019 года FDA одобрило erdafitinib для лечения метастатического или местно-распространенного рака мочевого пузыря с изменением FGFR3 или FGFR2, которое выходит за рамки традиционной терапии на основе платины, при условии проведения подтверждающих исследований.
Когда FDA преобразует ускоренное одобрение в полное, это обычно связано с более широкой маркировкой имеющегося препарата. Но в случае с Balversa и компании Johnson &Johnson FDA сузило использование first-in-class препарата от рака мочевого пузыря двумя способами и расширило его другим.
Полное одобрение FDA теперь позволяет Balversa лечить местно-распространенную или метастатическую уротелиальную карциному у пациентов с восприимчивыми генетическими изменениями FGFR3 после хотя бы одной линии предшествующей терапии. В пятничном объявлении об обновленной этикетке препарата FDA уточнило, что Бальверса не должна использоваться у пациентов, которые имеют право на терапию PD-1/L1 и не получали ее ранее.
Изменение регулятором этикетки для J&J является положительным фактором. В то время, как предыдущее одобрение допускало использование Balversa только после предварительного лечения химиотерапией на основе платины, обновленное одобрение теперь распространяется и на пациентов второй линии, независимо от их предшествующей системной терапии. Это означает, что пациенты, у которых наблюдается прогресс на стандартном лечении PD-1, также могут получить Balversa.
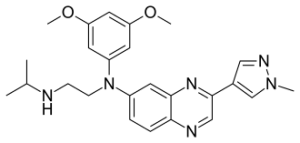
То, как J&J подошла к полному одобрению, и то, как вынесло решение FDA, говорит о пристальном внимании регулятора к данным подгрупп пациентов и общим результатам выживаемости.
Несмотря на то, что большинство уротелиальных карцином диагностируются на ранней стадии, частота рецидивов и прогрессирования заболевания высока.
Дополнительная заявка на новый препарат (New Drug Application, NDA) для Balversa была поддержана результатами первой группы пациентов в клиническом исследования (КИ) THOR в фазе 3, продемонстрировавшими несомненную клиническую пользу препарата в увеличении общей выживаемости сравнительно с химиотерапией.
Исследование достигло основной конечной точки общей выживаемости – Balversa показал снижение риска смерти на 36% по сравнению с химиотерапией у пациентов с метастатической или неоперабельной уротелиальной карциномой и отдельными изменениями гена FGFR, которые ранее получали лечение анти-PD-L1.
Киран Патель (Kiran Patel), вице-президент J&J Innovative Medicine по клиническим разработкам и солидным опухолям, заявил: «Основываясь на результатах рандомизированных данных фазы 3, Balversa продолжает демонстрировать перспективность таргетной терапии в лечении пациентов с распространенным раком мочевого пузыря. Эта важная веха укрепляет нашу приверженность продвижению инновационных и точных методов лечения онкологии и подтверждает роль таргетной терапии в лечении рака мочевого пузыря».
Janssen Pharmaceuticals, подразделение J&J, подписала глобальное лицензионное и партнерское соглашение с Astex Pharmaceuticals на разработку и маркетинг BALVERSA в 2008 году.
Одобрение было получено менее чем через 2 недели после того, как J&J сообщила, что приобретет компанию Ambrx Biopharma, специализирующуюся на конъюгатах антител и лекарств (antibody drug conjugates, ADC), примерно за $2 млрд.

Благодаря этому солидному приобретению J&J получит доступ к ADC, нацеленному на простатспецифический мембранный антиген, для лечения метастатического, резистентного к кастрации рака простаты (metastatic castration-resistant prostate cancer), а также – к ADC, нацеленному на рецептор 2 эпидермального фактора роста человека при метастатическом HER2-положительном раке молочной железы (metastatic HER2-positive breast cancer). Кроме того, большие перспективы эксперты видят в кандидате, сфокусированном на белок, который у человека кодируется как CD70 при почечно-клеточном раке (renal cell carcinoma).
Источник: https://www.pmlive.com/
Источник: https://www.fiercepharma.com/
Источник: https://www.onclive.com/
24.01.2024