Препарат Enhertu sBLA получил от FDA статус Priority Review для лечения рака молочной железы
FDA одобрило препарат Enhertu sBLA от AZN и Daiichi для лечения метастатического HER2-положительного рака молочной железы с применением препарата Perjeta. В исследовании III фазы медиана выживаемости без прогрессирования составила 41 месяц по сравнению с 27 месяцами при стандартной терапии.

Enhertu обеспечил 85,1% ответ, превысив 78,6% для Taxane с Herceptin и Perjeta. Компания AstraZeneca и её японский партнёр Daiichi Sankyo объявили о том, что FDA приняло дополнительную заявку на получение лицензии на биологический препарат (supplemental biologics license application, sBLA), которая направлена на расширение области применения их популярнейшего конъюгата антитело-лекарственный препарат (ADC) Enhertu для лечения рака молочной железы.
sBLA ходатайствует о регистрации Enhertu в сочетании с противоопухолевым препаратом Perjeta (pertuzumab) компании Roche для первой линии терапии взрослых пациентов с неоперабельным или метастатическим HER2-положительным раком молочной железы. Заявка получила приоритетное рассмотрение FDA, что сокращает срок рассмотрения на 4 месяца. Окончательное решение ожидается в первом квартале 2026 года.
Приоритетное рассмотрение FDA (FDA Priority Review) — статус, который ускоряет процесс рассмотрения FDA лекарственных препаратов, которые, как ожидается, обеспечат значительное повышение безопасности или эффективности лечения серьёзных заболеваний. Это ускоряет доступ пациентов к перспективным новым методам лечения, сокращая целевой срок рассмотрения с 10 до 6 месяцев. Этот статус позволяет FDA сосредоточить ресурсы на препаратах, представляющих собой значительный терапевтический прорыв или удовлетворяющих существенную неудовлетворённую медицинскую потребность.

AZN, Daiichi гордятся превосходством Enhertu
Заявка sBLA подкреплена данными исследования III фазы DESTINY-Breast09, в котором комбинация Enhertu-Perjeta сравнивалась с действующим стандартом лечения — химиотерапией таксанами в сочетании с противоопухолевыми препаратами компании Roche Herceptin и Perjeta (общее название комбинации –THP). В этом исследовании была достигнута первичная конечная точка — выживаемость без прогрессирования (ВБП), поскольку лечение Enhertu в сочетании с Perjeta снизило риск прогрессирования заболевания на 44% по сравнению с THP. Медиана ВБП составила почти 41 месяц против примерно 27 месяцев при THP.
Схема Enhertu-Perjeta также продемонстрировала более высокую частоту объективных ответов (ЧОО) — 85,1% (включая 58 полных ответов) по сравнению с 78,6% (включая 33 полных ответа) при THP.
AstraZeneca отметила, что эти результаты знаменуют собой первый значительный прогресс в лечении первой линии HER2-положительного метастатического рака молочной железы за более чем десятилетие. В случае одобрения эта комбинация может стать новым стандартом лечения. Препарат Enhertu уже одобрен для второй линии терапии пациентов с HER2-положительным раком молочной железы более чем в 85 странах, включая США. Препарат также одобрен для применения по показаниям, связанным с HER2-таргетной терапией при раке легких и желудка.
С начала года акции AstraZeneca выросли на 15% по сравнению с ростом отрасли на 4%.
Сделка AZN с Daiichi по Enhertu и другим препаратам ADC
Enhertu — первый препарат ADC, разработанный в рамках сотрудничества AstraZeneca и Daiichi Sankyo. За ним последовал препарат Datroway, который получил свое первое одобрение FDA в начале этого года для лечения рака молочной железы, а недавно — и рака легких. Согласно условиям партнерства, обе компании совместно отвечают за разработку и продвижение препаратов по всему миру, за исключением Японии, где Daiichi сохраняет исключительные права на оба препарата. Daiichi также отвечает за производство и поставку Enhertu и Datroway. Обе компании реализуют масштабные программы разработки Enhertu и Datroway, тестируя их в качестве монотерапии и в комбинированных препаратах для лечения различных типов опухолей.
По данным AstraZeneca, Enhertu и Datroway входят в группу препаратов, которые могут достичь пикового годового объема продаж не менее $5 млрд. Эти препараты играют ключевую роль в амбициозной стратегии роста компании, направленной на достижение $80 млрд годового дохода к 2030 году.
Конкуренция AZN на развивающемся рынке ADC
ADC считаются прорывными инновациями в фармацевтической промышленности, поскольку они позволят улучшить лечение рака за счет использования таргетной способности антител для доставки цитотоксических молекулярных препаратов к опухолям.
Daiichi Sankyo проводит клинические разработки нескольких ADC для лечения различных типов рака. Как и AstraZeneca, Daiichi также имеет аналогичное партнерство с Merck. Это соглашение с MRK, подписанное в 2023 году, включает разработку трех экспериментальных ADC — патритумаба дерукстекана, ифинатамаба дерукстекана и ралудотатуга дерукстекана — для лечения различных солидных опухолей. По данным Merck, эта сделка несет в себе многомиллиардный потенциал глобальной коммерческой выручки для каждой компании к середине 2030-х годов.
Pfizer также вышла на прибыльный рынок ADC, приобретя Seagen за $43 млрд в конце 2023 года. После этого приобретения Pfizer добавила в свой портфель четыре ADC — Adcetris, Padcev, Tukysa и Tivdak — все они одобрены для лечения различных типов солидных опухолей и гематологических злокачественных заболеваний. Эти продукты внесли значительный вклад в выручку Pfizer в первой половине 2025 года.
О препарате Perjeta
Pertuzumab, продаваемый под торговой маркой Perjeta, представляет собой моноклональное антитело, применяемое в комбинации с трастузумабом и доцетакселом для лечения метастатического HER2-положительного рака молочной железы; он также используется в той же комбинации в качестве неоадъювантной терапии при раннем HER2-положительном раке молочной железы.
Побочные эффекты более чем у половины пациентов, принимающих Pertuzumab, включают диарею, выпадение волос и потерю нейтрофилов; более чем у 10% наблюдается потеря эритроцитов, гиперчувствительность или аллергические реакции, инфузионные реакции, снижение аппетита, бессонница, искажение вкусовых ощущений, воспаление полости рта или губ, запор, сыпь, заболевания ногтей и мышечные боли. Это первый в своем классе препарат, называемый «ингибитором димеризации HER2» — он ингибирует димеризацию HER2 с другими рецепторами HER, что препятствует их передаче сигналов, способствующих росту и пролиферации клеток.
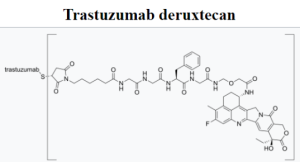
О препарате Enhertu
Препарат Enhertu (fam-trastuzumab deruxtecan-nxki) – это таргетная терапия, а именно конъюгат антитела с лекарственным препаратом (ADC), направленный на HER2, разработанный компаниями Daiichi Sankyo и AstraZeneca, применяемый для лечения некоторых видов запущенных HER2-положительных и HER2-низкоклеточных опухолей, включая рак молочной железы, желудка, гастроэзофагеального перехода и немелкоклеточный рак лёгкого. Препарат действует путем доставки химиотерапевтических препаратов непосредственно к HER2-экспрессирующим раковым клеткам, минимизируя повреждение здоровых клеток и обеспечивая высокоточную терапию. Препарат продемонстрировал эффективность у пациентов, ранее получавших другие виды лечения, и показан в первую очередь взрослым с метастатическим HER2-положительным раком молочной железы.
Источник: https://www.zacks.com/
Источник: https://www.chemicalbook.com/
26.09.2025