Препарат китайской Dizal получает статус Fast Track Designation для лечения хронического лимфолейкоза и лимфоцитарной лимфомы
Dizal, биофармацевтическая компания, занимающаяся разработкой новых лекарственных средств для лечения рака и иммунологических заболеваний, объявила, что FDA предоставило статус Fast Track Designation препарату бирелентиниб (Birelentinib, DZD8586) для лечения рецидивирующего/рефрактерного хронического лимфолейкоза (ХЛЛ) либо мелкоклеточной лимфомы (МЛЛ). Имеется в виду лечение взрослых пациентов с ХЛЛ/МЛЛ, получивших как минимум две предшествующие линии терапии, включая ингибитор BTK и ингибитор BCL-2.

У пациентов с ХЛЛ/МЛЛ, получающих ингибитор BTK или ингибитор BCL-2, часто наблюдается рецидив или прогрессирование заболевания из-за двух основных механизмов резистентности: мутаций BTK C481X и BTK-независимой активации сигнального пути BCR. В настоящее время не существует таргетной терапии, воздействующей на оба механизма, что представляет собой неотложную клиническую проблему.
Хотя деградаторы BTK продемонстрировали обнадеживающую противоопухолевую активность в ранних клинических исследованиях ХЛЛ/МЛЛ, уже сообщалось о случаях резистентности, обусловленной мутациями, а токсичность, связанная с деградаторами, может ограничивать их долгосрочное клиническое применение.
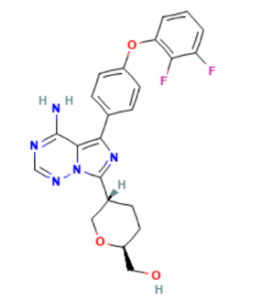
Birelentinib — first-in-class нековалентный двойной ингибитор LYN/BTK, обладающий полным проникновением через гематоэнцефалический барьер (ГЭБ). Он обладает высокой селективностью в отношении других киназ семейства TEC (TEC, ITK, TXK и BMX). Воздействуя как на BTK, так и на LYN, он блокирует как BTK-зависимые, так и -независимые сигнальные пути BCR, эффективно подавляя рост опухоли B-клеточных неходжкинских лимфом (B-NHLs).
Статус Fast Track подтверждается данными объединенного анализа двух исследований I/II фазы Birelentinib у пациентов с ХЛЛ/МЛЛ, ранее получавших ковалентные/нековалентные ингибиторы BTK и деградаторы BTK. Результаты были представлены на Ежегодном конгрессе Европейской гематологической ассоциации (EHA) 2025 года и были представлены в устных докладах как на Ежегодном собрании Американского общества клинической онкологии (ASCO) 2025 года, так и на 18-й Международной конференции по злокачественным лимфомам (ICML).

Birelentinib продемонстрировал значительную противоопухолевую эффективность у пациентов с ХЛЛ/МЛЛ, ранее проходивших интенсивное лечение, с частотой объективного ответа (ЧОО) 84,2% и хорошим профилем безопасности. Ответ опухоли наблюдался независимо от предшествующего лечения ковалентными/нековалентными ингибиторами BTK, деградаторами BTK или ингибиторами BCL-2, в том числе у пациентов с классическими мутациями резистентности BTK (C481X), а также с другими мутациями BTK, такими как мутации, приводящие к гибели киназы. Ответ был стойким, с расчетной частотой 9-месячного ответа (ПДО) 83,3%.
«Присвоение статуса ускоренного рассмотрения подчёркивает признание Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) потенциала Birelentinib в решении неудовлетворённой медицинской потребности пациентов с ХЛЛ/МЛЛ», — заявил д-р Сяолинь Чжан (Xiaolin Zhang), генеральный директор компании Dizal.
О препарате Birelentinib (DZD8586).
Birelentinib – first-in-class нековалентный двойной ингибитор LYN/BTK с полным проникновением через гематоэнцефалический барьер (ГЭБ), разработанный как потенциальный вариант лечения В-клеточной неходжкинской лимфомы (В-НХЛ). Хотя ингибиторы тирозинкиназы Брутона (BTK) были одобрены для лечения В-НХЛ, резистентность может возникать по двум основным механизмам: мутации C481X в гене BTK и активации сигнального пути BCR, независимого от BTK. В настоящее время не существует таргетной терапии, воздействующей на оба механизма резистентности, что представляет собой неотложную клиническую проблему. Хотя деградаторы BTK продемонстрировали обнадеживающую эффективность в ранних клинических исследованиях, сообщалось о развитии резистентности, связанной с мутациями, а токсичность, связанная с деградаторами, может повлиять на долгосрочное клиническое применение.
О компании Dizal
Dizal — созданная в 2017 году в Китае биофармацевтическая компания, занимающаяся поиском, разработкой и коммерциализацией дифференцированных терапевтических средств для лечения рака и иммунологических заболеваний. Dizal стремится разрабатывать передовые и революционные новые лекарственные препараты, а также удовлетворять неудовлетворенные потребности мировой медицины. Глубоко укоренившись в трансляционной науке и молекулярном дизайне, компания создала конкурентоспособный на международном уровне портфель препаратов, включающий многочисленные активы, участвующие в глобальных опорных исследованиях, и два ведущих препарата: ZEGFROVY® (sunvozertinib), одобренный в США и Китае, и golidocitinib, одобренный в Китае.
Источник: https://www.manilatimes.net/
Источник: https://www.bloomberg.com/
7.08.2025