Решение FDA об одобрении бимекизумаба для лечения псориаза отложено
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) продолжает рассмотрение заявки на получение лицензии на биологические препараты для бимекизумаба для лечения псориаза. Решение по заявке ожидалось к концу июня, но по неизвестным причинам было отложено до третьего квартала текущего года.
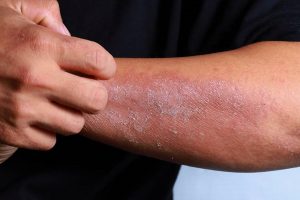
Бимекизумаб представляет собой моноклональное антитело, которое ингибирует интерлейкин (IL)-17A и IL-17F, два фактора воспаления. Производитель, бельгийская фармацевтическая компания UCB, рассчитывает получить одобрение в Соединенных Штатах для лечения взрослых с бляшечным псориазом средней и тяжелой степени.
Биопрепарат был одобрен для этого показания в Европейском Союзе, а также в Канаде, Австралии, Японии и Саудовской Аравии. Он продается под маркой Bimzelx. Ранее в этом месяце Европейская комиссия одобрила лечение по дополнительным показаниям активного псориатического артрита и активного аксиального спондилоартрита. В январе 2022 года он был одобрен в Японии для лечения генерализованного пустулезного псориаза и псориатической эритродермии.
В октябре 2021 года компания объявила, что FDA не может завершить проверку для бимекизумаба, поскольку ограничения на поездки в связи с COVID-19 не позволили представителям регулятора посетить производственные предприятия в Европе.
Источник: https://www.medscape.com/
27.06.2023