«Сервье» регистрирует в EMA Ivosidenib в таблетках
Международная фармацевтическая компания «Сервье» объявила о подаче в Европейское агентство по лекарственным средствам (EMA) заявки на получение регистрационного удостоверения для препарата Ivosidenib (Ивосединиб, таблетки) по двум показаниям: для применения в качестве терапии первой линии в комбинации с азацитидином у пациентов с ранее нелеченым острым миелоидным лейкозом (ОМЛ) с мутацией в гене IDH1, которым противопоказана интенсивная химиотерапия, а также у пациентов с местнораспространенной или метастатической холангиокарциномой с мутацией в гене IDH1, ранее получавших лечение.
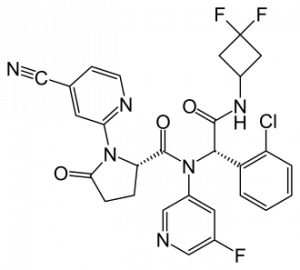
Лекарственный препарат Ивосидениб представляет собой ингибитор мутантного фермента изоцитратдегидрогеназы-1 (IDH1). Он является первым специфичным к мутации в гене IDH1 препаратом таргетной терапии, заявленным к регистрации в Европе.
Клод Бертран, исполнительный вице-президент отдела исследований и разработок группы компаний «Сервье»: «Заявка на получение регистрации в Европе является важным шагом на пути к обеспечению доступности Ивосидениба — таргетной терапии для пациентов с острым миелоидным лейкозом с мутацией в гене IDH1, ранее не получавших лечения, а также для пациентов с местнораспространенной или метастатической холангиокарциномой с мутацией в гене IDH1, ранее получавших лечение. Возможности терапии этих двух редких типов онкологических заболеваний крайне ограничены. Мы рассчитываем на плодотворное взаимодействие с EMA в рамках процедуры оценки Ивосидениба, который является первым заявленным к регистрации в Европе специфичным к мутации в гене IDH1 препаратом таргетной терапии».

Доктор Филипп Гоннар, исполнительный вице-президент международного отдела по медицинским вопросам и работе с пациентскими организациями группы компаний «Сервье»: «Группа компаний «Сервье» стремится найти новые терапевтические решения для пациентов с трудноизлечимыми видами злокачественных новообразований и высокой потребностью в медицинской помощи. Поданная в EMA заявка дает надежду на то, что ивосидениб вскоре станет доступен для пациентов с впервые диагностированным ОМЛ с мутацией в гене IDH1, а также для пациентов с местнораспространенной или метастатической холангиокарциномой с мутацией в гене IDH1, ранее получавших лечение».
Острый миелоидный лейкоз (ОМЛ) — это клональное опухолевое заболевание крови и костного мозга, характеризующееся быстрым прогрессированием. ОМЛ представляет собой самую частую форму острого лейкоза у взрослых пациентов и встречается у 5,06/100 000 жителей Европы, т. е. частота заболевания составляет более 20 000 новых случаев в год . Пятилетняя выживаемость среди пациентов старше 60 лет составляет 20%.

Холангиокарцинома
Холангиокарцинома, рак желчных протоков, представляет собой редкую и агрессивную злокачественную опухоль, часто связанную с наличием в анамнезе цирроза или инфекций печени. Распространенность холангиокарциномы в Европе составляет 1–3 случая на 100 000 человек, т. е. ежегодно в Европе регистрируют около 10 000 новых случаев данного заболевания . Пятилетняя выживаемость составляет 9 %, однако при метастазировании становится нулевой. Единственным радикальным методом лечения является оперативное вмешательство, однако его применение возможно только у ограниченного числа пациентов, при этом риск рецидива заболевания остается высоким. Стандартным методом лечения пациентов с холангиокарциномой, которым противопоказано хирургическое вмешательство или у которых заболевание прогрессировало после хирургического вмешательства, является химиотерапия. Разрабатываемые в настоящее время препараты иммунотерапии и новые таргетные методы лечения позволяют улучшить качество и увеличить продолжительность жизни пациентов.
Данная заявка на регистрацию включает 27 стран Европейского союза, а также Исландию, Лихтенштейн и Норвегию.
Ивосидениб в настоящее время зарегистрирован в США в качестве монотерапии для лечения взрослых пациентов с рецидивирующей или рефрактерной формой ОМЛ с мутацией в гене IDH1, а также для лечения взрослых пациентов с впервые диагностированным ОМЛ с мутацией в гене IDH1 в возрасте 75 лет и старше или с сопутствующими заболеваниями, которые исключают применение интенсивной индукционной химиотерапии. Кроме того, с 2021 г. Ивосидениб является первым и единственным препаратом таргетной терапии, одобренным Управлением США по контролю за качеством пищевых продуктов и лекарственных средств (FDA) для применения у пациентов с местнораспространенной или метастатической холангиокарциномой с мутацией в гене IDH1, ранее получавших лечение. Ивосидениб также одобрен Национальным управлением медицинских продуктов Китая (NMPA) для лечения взрослых пациентов с рецидивирующей или рефрактерной формой ОМЛ и восприимчивой мутацией в гене IDH1.
Компания «Сервье» оформила эксклюзивное лицензионное соглашение с компанией «СиСтоун» (CStone) на разработку и вывод на рынок препарата ивосидениб в таблетках на территории материкового Китая, Тайваня, Гонконга, Макао и Сингапура.
Источник: https://pharmprom.ru
17.03.2022