Stealth BioTherapeutics объявляет об ускоренном одобрении FDA первого препарата для лечения синдрома Барта
Stealth BioTherapeutics Inc., коммерческая биотехнологическая компания, специализирующаяся на поиске, разработке и коммерциализации новых методов лечения заболеваний, связанных с митохондриальной дисфункцией объявила, что FDA выдало ускоренное одобрение препарату FORZINITY™ (elamipretide HCl) для улучшения мышечной силы у взрослых и детей с синдромом Барта весом не менее 30 кг.

Синдром Барта (Barth syndrome) — ограничивающее продолжительность жизни крайне редкое митохондриальное кардиоскелетное заболевание у детей, которым страдают около 150 человек в США.
«Одобрение FORZINITY™, первого варианта лечения синдрома Барта и первого одобренного препарата, воздействующего на митохондрии, является важной победой для сообщества, занимающегося синдромом Барта, и вселяет надежду на ускоренное внимание регулирующих органов к другим крайне редким заболеваниям», — заявила Рини Маккарти, генеральный директор Stealth.
Stealth BioTherapeutics планирует продолжать предоставлять расширенный доступ к препарату детям весом менее 30 килограммов, которые в настоящее время получают лечение или нуждаются в экстренной помощи, одновременно работая с FDA над сбором данных, необходимых для расширения таких показаний к применению препарата.
Одобрение препарата FORZINITY™ подтверждается данными об эффективности и безопасности, полученными в ходе клинического исследования TAZPOWER. В ходе открытой части исследования TAZPOWER сила мышц-разгибателей колена увеличилась по сравнению с исходным уровнем исследования. Наиболее частыми нежелательными реакциями были реакции в месте инъекции, которые можно лечить пероральными антигистаминными препаратами или местными кортикостероидами. Дальнейшее одобрение по этому показанию может зависеть от подтверждения клинической эффективности в подтверждающем исследовании.

Это решение стало результатом многомесячного совместного диалога с FDA по согласованию окончательных этапов нормативного регулирования после получения компанией Stealth в мае 2025 года полного ответа от FDA. Одобрение отражает общую приверженность обеспечению своевременного доступа к препарату для пациентов, столкнувшихся с этим разрушительным заболеванием.
«Мы благодарны руководству FDA за то, что оно прислушалось к мнению нашего сообщества и одобрило препарат FORZINITY™ для некоторых наших пациентов. Пациенты с синдромом Барта каждый день живут с постоянно ухудшающимся качеством жизни», — сказала Кейт Маккарти, председатель правления Фонда синдрома Барта, чей сын скончался от этой болезни в возрасте 28 лет. «Я была свидетелем ужасных последствий этой болезни для моего сына каждый день и множества серьёзных медицинских проблем, которые это вызвало. Наши пациенты и их врачи увидели поистине положительное влияние FORZINITY™ на разрушительную мышечную слабость, ограничивающую повседневную активность. Отмечая этот важнейший рубеж, мы глубоко осознаём, что только половина наших пациентов доживает до веса в 30 килограммов, необходимого для получения этого лечения сейчас. Поэтому мы высоко ценим обещание Stealth тесно сотрудничать с FDA в целях скорейшего и широкого расширения охвата, чтобы наши самые юные и уязвимые пациенты также могли получить доступ к этой терапии».
«Я очень рада, что у меня есть одобренное FDA лечение, которое я могу предложить пациентам с синдромом Барта, которые часто сталкиваются с серьёзными проявлениями, включая выраженную мышечную слабость», — сказала Хилари Вернон, доктор медицины, профессор генетической медицины в Медицинской школе Университета Джонса Хопкинса, основательница и директор Клиники синдрома Барта в Институте Кеннеди Кригера. «Как директор одной из двух междисциплинарных клиник синдрома Барта в мире, я имею честь взаимодействовать со значительной частью сообщества Барта в США и во всём мире, и я благодарна за то, что у меня есть новый терапевтический вариант, доступный для пациентов с синдромом Барта. Я с нетерпением жду возможности возглавить Комитет по научному обзору клинических испытаний в рамках пострегистрационного исследования, поскольку знаю об огромном интересе к участию пациентов по всему миру».
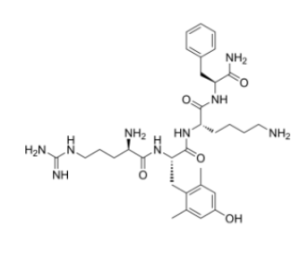
FORZINITY™ получил от FDA все возможные для него основные статусы: орфанного препарата, ускоренного рассмотрения, приоритетного рассмотрения и редкого педиатрического препарата.
Компания Stealth стремится обеспечить бесперебойный доступ к препарату всем пациентам с синдромом Барта. Stealth планирует сотрудничать с плательщиками и поставщиками медицинских услуг для обеспечения своевременного и равноправного доступа к препарату FORZINITY™, который, как ожидается, будет доступен по рецепту в США в специализированной аптеке к концу года. Stealth планирует объявить о своих инициативах по поддержке пациентов и расширению доступа в ближайшие недели.
О синдроме Барта
Синдром Барта — крайне редкое генетическое заболевание, характеризующееся митохондриальными аномалиями, приводящими к непереносимости физических нагрузок, мышечной слабости, изнурительной усталости, сердечной недостаточности, рецидивирующим инфекциям и задержке роста. Заболевание связано с сокращением продолжительности жизни: 85% ранних смертей приходится на возраст до 5 лет. Синдром Барта встречается преимущественно у мужчин и, по оценкам, поражает одного из 1 000 000 новорожденных мальчиков, или около 150 человек в США. Методов лечения, одобренных Европейским агентством по лекарственным препаратам (EMA), для пациентов с синдромом Барта не существует.

О компании Stealth BioTherapeutics
Миссия Stealth BioTherapeutics — разработка новых методов лечения для улучшения жизни пациентов с заболеваниями, связанными с дисфункцией митохондрий. Коммерческий препарат компании Stealth, FORZINITY™, получил ускоренное одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в сентябре 2025 года в качестве первого одобренного FDA препарата для лечения синдрома Барта, а также первого одобренного FDA митохондриально-таргетного препарата. Дальнейшее одобрение по этому показанию может зависеть от подтверждения клинической эффективности в подтверждающих исследованиях. Stealth изучает эламипретид по другим показаниям, включая сухую возрастную макулярную дегенерацию и первичную митохондриальную миопатию, и разрабатывает свой кандидат второго поколения на клинической стадии – бевемипретид (SBT-272) – для лечения офтальмологических и неврологических заболеваний.
Источник: https://www.prnewswire.com/
Источник: https://www.barthsyndrome.org/
22.09.2025