Сразу 3 фармкомпании получили полное ответное письмо от FDA
Агентство по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) быстро наверстывает упущенное после того, как COVID-19 нарушил традиционные сроки запланированных проверок. Сегодня сразу трем фармкомпаниям пришли плохие новости от регулятора. Компании Shanghai Junshi Biosciences и Coherus Biosciences получили полное ответное письмо (Complete Response Letter, CRL) после подачи заявки на коммерциализацию своего биологического препарата против карциномы носоглотки, а Axsome Therapeutics получила CRL для средства от острой мигрени AXS-07.

Junshi Biosciences и Coherus Biosciences
Shanghai Junshi и Coherus выпустили совместный пресс-релиз, касающийся получения ими CRL, где подробно описали изменения, которые Агентство хотело бы увидеть, прежде чем принимать официальное решение об одобрении торипалимаба, терапевтического средства для пациентов с карциномой носоглотки (nasopharyngeal carcinoma, NPC).

После внесения запрошенных изменений в процесс обеспечения качества, компаниями будет повторно подана заявка на лицензирование биологических препаратов (BLA) для данного терапевтического средства с целью представить вариант лечения в области медицины с ранее неудовлетворенной потребностью.

Препятствия на пути сотрудничества по коммерциализации торипалимаба между двумя компаниями по-прежнему остаются, поскольку пандемия COVID-19 все еще свирепствует в Китае. Несмотря на существующие трудности, были установлены установили амбициозные сроки решения поставленных задач. Ожидается, что вопросы рассмотрения и внесения изменений и повторной подачи BLA будут решены к середине лета 2022 года.
Генеральный директор Coherus Денни Ланфир прокомментировал краткосрочную стратегию компании: «FDA указало, что существующие клинические данные торипалимаба подтверждают представление BLA, мы с нетерпением ждем завершения необходимых проверок в Китае, которым до сих пор препятствовали ограничения, связанные с COVID-19». «Мы убеждены, что торипалимаб соответствует неудовлетворенной потребности пациентов с карциномой носоглотки, для которых сейчас в США нет одобренных иммунотерапевтических средств. В то же время, FDA заявило, что данное показание требует гибкости в регулировании относительно достаточности клинических данных в одной стране».
Axsome Therapeutics
Axsome Therapeutics также находится в постоянном контакте с FDA, чтобы ускорить решение проблем, связанных с данными о производстве и контроле препарата.
Генеральный директор компании Эррио Табуто, доктор медицинских наук, так прокомментировал получение полного ответного письма: «Наша цель — работать с FDA, чтобы полностью разобраться и адекватно ответить на комментарии, и как можно быстрее сделать это важное новое лекарство доступным для пациентов с мигренью. Одобрение AXS-07 обеспечит столь необходимый новый вариант терапии для миллионов людей, живущих с этим изнурительным неврологическим заболеванием».
AXS-07 — это пероральное быстродействующее средство от мигрени, основанное на сочетании ризатриптана с мелоксикамом, разработанное с использованием технологии комплекса включения Axsome с улучшенной молекулярной растворимостью (MoSEIC).
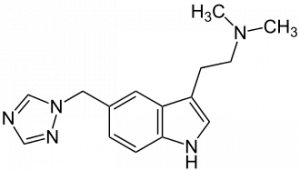
ризатриптан
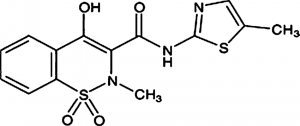
мелоксикам
Хотя возможности лечения мигрени расширились за последнее десятилетие, в пресс-релизе приводится статистика, оценивающая удовлетворенность пациентов текущим режимом лечения: «Опубликованные опросы страдающих мигренью показывают, что более 70% не полностью удовлетворены своим текущим лечением, а почти 80% попробовали бы новую терапию. Все они хотят, чтобы лечение работало быстрее, стабильнее и приводило к меньшему количеству рецидивов».
Источник: https://www.biospace.com/
3.05.2022