В Минздраве не зафиксировали серьезных побочных реакций у фавипиравира
Ранее в информационном центре на базе ведомства сообщили, что в инструкции к японскому препарату содержится предупреждение о возможных побочных эффектах.
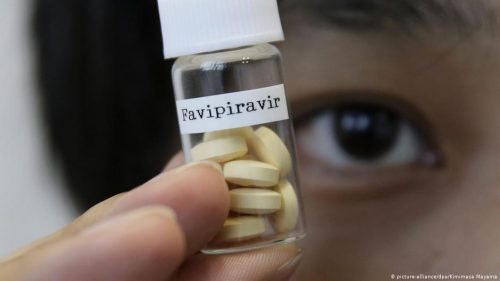
В Минздраве пояснили, что они были зафиксированы у пациентов с гриппом. Серьезных нежелательных реакций на препарат для лечения коронавируса Фавипиравир в России не зафиксировали. Об этом говорится в заявлении помощника главы Минздрава России Алексея Кузнецова, которое поступило РБК от пресс-службы ведомства. «Препараты фавипиравира отечественного производства, зарегистрированные для применения у пациентов с новой коронавирусной инфекцией, доказали свою эффективность и безопасность по результатам трех фаз клинических исследований и успешно используются для лечения пациентов с COVID-19. Случаев серьезных нежелательных побочных реакций на применение препаратов, в нашей стране не зафиксировано», — сообщил Кузнецов. Он также подчеркнул, что с момента регистрации эти препараты входят в систему обязательной маркировки движения лекарств, что позволяет отслеживать движение каждой упаковки. Таким образом в ведомстве ответили на публикацию Информационного центра по вопросам фармакотерапии у пациентов с новой коронавирусной инфекцией COVID-19 «ФармаCOVID» на базе ФГБОУ ДПО РМАНПО Минздрава России. В ней центр указал, что в инструкции к японскому препарату Авиган (фавипиравир) говорится о возможных нежелательных эффектах. В частности, у пациентов могут появляться неспецифические моторные нарушения, способные вызвать падения. В Минздраве подчеркнули, что возможные моторные нарушения, о которых шла речь, наблюдались у пожилых пациентов при гриппе. «При этом, подчеркну, что указанные побочные эффекты производители японского препарата связывают именно с гриппом, а не с последствиями применения препарата», — сказал Кузнецов. Ранее об отсутствии данных о возможных побочных эффектах фавипиравира сообщал Росздравнадзор.
Источник: https://www.rbc.ru/rbcfreenews/5f801f949a7947030423ce22
12.10.2020