Противораковые препараты компаний Spectrum и Oncopeptides не получили одобрение экспертов
Шансы на одобрение препаратов Рosiotinib Spectrum Pharma для лечения рака легких и Pepaxto от Oncopeptides для лечения множественной миеломы резко упали после того, как эксперты регулирующего органа проголосовали за то, что они не готовы к выходу на рынок.

Было маловероятно, что обе компании получат положительный результат от Консультативного комитета по онкологическим препаратам (Oncology Drugs Advisory Committee, ODAC) после осуждающих оценок рецензента в документах, опубликованных до вчерашних решений, и их акции еще более упали после вынесения вердиктов.

Участники дискуссии проголосовали 9 против 4, что pan-HER2 ингибитор 2 posiotinib не должен быть одобрен FDA для пациентов с немелкоклеточным раком легкого (НМРЛ) со вставкой экзона 20 HER2, несмотря на их острую потребность в вариантах лечения.
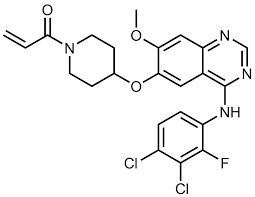
Рosiotinib
Эксперты выразили обеспокоенность по поводу предельной эффективности, высоких показателей токсичности и дозировки, выбранной в клинических испытаниях, а также заявили, что обеспокоены задержкой начала подтверждающих испытаний препарата.
Эти опасения вызвали многочисленные дебаты, при этом участники дискуссии отметили, что отсутствие оптимизации дозы posiotinib означает, что трудно оценить, можно ли справиться с токсичностью, связанной с препаратом.

По словам Скотта Уолдмана из Университета Томаса Джефферсона, ключевой вопрос заключается в том, что подтверждающее исследование PINNACLE, в которое еще не начат набор пациентов, а значит, и результатов не стоит ждать до 2026 года, не предназначено для тестирования той же дозы, для которой Spectrum ищет одобрения.
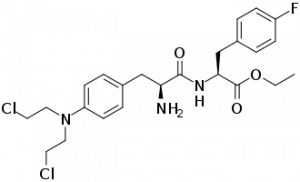
Melphalan flufenamide (Pepaxto)
В своем заявлении исполнительный директор Spectrum Pharma Том Рига сказал, что он «разочарован результатами встречи комитета, поскольку пациенты с инсерционными мутациями экзона 20 HER2 НМРЛ нуждаются в дополнительных эффективных и безопасных методах лечения».
Он добавил, что компания «тщательно оценит наши варианты» до 24 ноября, когда FDA должно принять решение по заявке. Акции компании упали на 27%.
Похожая история произошла и с Oncopeptides: консультанты проголосовали 14 голосами против 2 за то, что соотношение пользы и риска для Pepaxto (melphalan flufenamide или melflufen) не было благоприятным для предлагаемой популяции взрослых пациентов с множественной миеломой, получивших не менее четырех предыдущих линии терапии.
Oncopeptides ищут одобрение для пациентов, чье заболевание устойчиво к как минимум одному ингибитору протеасом, одному иммуномодулирующему агенту и одному моноклональному антителу, направленному против CD38, — другими словами, для тех, кто уже исчерпал большинство вариантов лечения.
Члены комиссии проголосовали за вопрос: «Учитывая потенциальное ухудшение общей выживаемости (ОВ), неспособность продемонстрировать улучшение выживаемости без прогрессирования заболевания (ВБП) и отсутствие соответствующей дозы, является ли профиль пользы и риска Pepaxto благоприятным в настоящее время для указанной популяции пациентов?»
Между тем, картина еще более осложнилась одобрением Pepaxto (как Pepaxti) Европейской комиссией в июне без каких-либо конкретных постмаркетинговых обязательств.
Oncopeptides попытались доказать, что более низкая ОВ, наблюдаемая у пациентов, принимавших Pepaxto, была связана с определенной субпопуляцией, но это не повлияло на ODAC, призвавший провести новые клинические исследования препарата, прежде чем он может быть одобрен.
«Мы по-прежнему уверены в нашей науке и данных», — заявил Джейкоб Линдберг, генеральный директор Oncopeptides, который признал, что интерпретации результатов были проблемой на встрече.
Источник: https://pharmaphorum.com/
26.09.2022