Vanrafia от Novartis получил статус Accelerated Approval для лечения IgA-нефропатии
Препарат Vanrafia (Аtrasentan) от Novartis получил от FDA статус ускоренного одобрения для лечения пациентов с редким заболеванием почек — иммуноглобулиновой А-нефропатией (immunoglobulin A nephropathy, IgAN). Нестероидная терапия предназначена для снижения избытка белка в моче (протеинурии) у взрослых с первичной IgAN, которые подвержены риску быстрого прогрессирования заболевания.

Ежегодно в США почти у 13 человек из 1 миллиона диагностируется IgAN. Несмотря на современные методы лечения, у 50% пациентов с IgAN и постоянной протеинурией в течение 10–20 лет после постановки диагноза развивается почечная недостаточность.
Когда IgA накапливается в почках, то повреждает их. Это нарушает фильтрующую функцию, и в результате почки начинают пропускать в мочу такие вещества, как кровь и белок. Несмотря на современные методы лечения, у половины пациентов с IgAN и постоянной протеинурией в течение 10–20 лет после постановки диагноза развивается почечная недостаточность. Принимаемый перорально 1 раз в день, Vanrafia является антагонистом рецептора эндотелина А (ETA), который можно добавлять к поддерживающей терапии, включая ингибитор ренин-ангиотензиновой системы (RAS) с ингибитором натрий-глюкозного котранспортера-2 (sodium-glucose co-transporter-2, SGLT2) или без него.
Решение FDA по препарату было основано на положительных результатах поздней стадии исследования ALIGN, в котором пациенты, получавшие Vanrafia в сочетании с ингибитором RAS, достигли клинически значимого и статистически значимого снижения протеинурии на 36,1% по сравнению с плацебо, причем результаты наблюдались уже на шестой неделе и сохранялись до 36-й недели.
Продолжение одобрения Vanrafia может зависеть от проверки клинической пользы в исследовании ALIGN, которое оценивает, замедляет ли препарат прогрессирование заболевания, измеряемое по предполагаемому снижению скорости клубочковой фильтрации на 136-й неделе.
Исследователь ALIGN и член руководящего комитета Ричард Лафайет (Richard Lafayette) из Медицинского центра Стэнфордского университета заявил в интервью: «Это одобрение знаменует собой важную веху для людей, живущих с IgAN, предлагая новый вариант, который можно легко интегрировать в их существующий план лечения… Vanrafia — это селективный антагонист рецептора ETA, который эффективно снижает протеинурию, основной фактор риска IgAN».
Одобрение поступило всего через две недели после того, как Fabhalta (iptacopan) для приема внутрь от Novartis был одобрен FDA в качестве первого средства для лечения крайне редкого заболевания почек — гломерулопатии комплемента 3. Fabhalta также был одобрен регулятором США для IgAN в августе.
О препарате Atrasentan
Atrasentan, продаваемый под торговой маркой Vanrafia, — это лекарственный препарат, используемый для снижения протеинурии, антагонист рецепторов эндотелина. Atrasentan был одобрен для медицинского применения в США в апреле 2025 года и показан для снижения протеинурии у взрослых с первичной нефропатией иммуноглобулина А с риском быстрого прогрессирования заболевания, как правило, при соотношении белка мочи к креатинину >= 1,5 г/г.
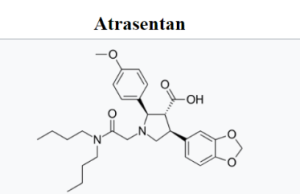
Atrasentan не прошел испытание III фазы рака простаты у пациентов, не поддающихся гормональной терапии. Второе испытание подтвердило этот вывод. В 2013 году было начато испытание SONAR с целью определить, снижает ли Atrasentan почечную недостаточность при диабетической болезни почек. В 2024 году исследование фазы III ALIGN показало, что атрасентан эффективен в снижении протеинурии у участников с IgA-нефропатией.
Atrasentan изучается для лечения различных типов рака, включая немелкоклеточный рак легких. Он также изучается в качестве терапии диабетической болезни почек.
Источник: https://pmlive.com/
Источник: https://www.ajmc.com/
7.04.2025