Zydus Therapeutics сообщает о положительных основных результатах клинического исследования Сароглитазара магния у пациентов с первичным билиарным холангитом
Zydus Therapeutics, дочерняя компания Zydus Lifesciences Ltd., глобальной инновационной медицинской компании, объявила о положительных основных результатах ключевого клинического исследования EPICS-III фазы 2(b)/3. В нем оценивалась безопасность и эффективность Saroglitazar Magnesium, экспериментального агониста альфа/гамма-рецепторов, активируемых пролифераторами пероксисом (PPAR), при лечении взрослых пациентов с первичным билиарным холангитом (ПБХ) с неадекватным ответом или непереносимостью урсодезоксихолевой кислоты (УДХК), являющейся действующим стандартом лечения.

Исследование достигло первичной конечной точки, при этом наблюдалось статистически значимое различие в процентном соотношении пациентов, достигших клинически значимого биохимического ответа при применении сароглитазара по сравнению с плацебо.
Saroglitazar в целом хорошо переносился, а общее количество нежелательных явлений было сопоставимо у пациентов, получавших препарат и плацебо. Zydus Therapeutics, американское специализированное подразделение Zydus Lifesciences Ltd, ориентированное на инновации, намерено подать заявку на регистрацию Saroglitazar в США в первом квартале 2026 года.
В ходе исследования была достигнута первичная комбинированная конечная точка: разница в достижении биохимического ответа составила 48,5% в пользу Saroglitazar 1 мг по сравнению с пациентами, получавшими плацебо (P < 0,001). Биохимический ответ определялся как уровень щелочной фосфатазы (ЩФ) < 1,67 от верхней границы нормы (ВГН), снижение уровня ЩФ ≥ 15% относительно исходного уровня и уровень общего билирубина ≤ ВГН или прямого билирубина ≤ ВГН у пациентов с диагностированным синдромом Жильбера через 52 недели. ЩФ и билирубин являются важными предикторами прогрессирования первичного билиарным холангитом.
Исследование также достигло ключевой вторичной конечной точки — доли пациентов с полной нормализацией уровня ЩФ, определяемой как ЩФ ≤ ВГН через 52 недели. В ходе исследования Saroglitazar в дозе 1 мг в целом переносился хорошо, а частота нежелательных явлений в целом была одинаковой у пациентов, принимавших препарат в дозе 1 мг, и пациентов, принимавших плацебо.
Говоря о разработке, председатель правления Zydus Lifesciences г-н Панкадж Патель (Pankaj Patel) отметил: «Результаты исследования EPICS-III подтверждают нашу приверженность разработке новых методов лечения хронических заболеваний печени — области с высокой неудовлетворенной медицинской потребностью и растущим глобальным влиянием. Saroglitazar — первый агонист PPAR альфа/гамма, показавший положительные результаты исследований фазы 3 у пациентов с ПБХ, и он способен принести реальную пользу как пациентам, так и их лечащим врачам. Мы намерены обсудить эти результаты с регулирующими органами, а также планируем подать заявку на регистрацию в FDA США в первом квартале 2026 года».
Полные данные исследования EPICS-III будут представлены на будущем научном конгрессе.
О первичном билиарном холангите (ПБХ)
Первичный билиарный холангит — редкое прогрессирующее аутоиммунное заболевание, которое постепенно разрушает желчные протоки, приводя к накоплению желчи в печени, что может привести к фиброзу, циррозу, необходимости трансплантации печени или смерти. ПБХ характеризуется повышением уровня биохимических маркеров, особенно щелочной фосфатазы (ЩФ) и билирубина. Клинические симптомы включают зуд и усталость, которые могут быть выраженными.
Об исследовании EPICS-III
EPICS-III (NCT05133336) — это многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое, бесшовное исследование фазы 2b/3, оценивающее эффективность и безопасность Saroglitazar у пациентов с ПБХ с резистентностью или непереносимостью урсодезоксихолевой кислоты (УДХК). После подбора оптимальной дозы в исследовании фазы 3 149 пациентов были рандомизированы в соотношении 2:1: Saroglitazar 1 мг или плацебо.
О препарате Saroglitazar
Saroglitazar (INN, брендовые названия Lipaglyn, Bilypsa) — это новый агонист альфа/гамма-рецепторов, активируемых пролифераторами пероксисом (PPAR), который в настоящее время изучается в качестве средства для лечения пациентов с ПБХ. Его уникальный биологический профиль направлен как на подавление токсичности желчных кислот, так и на воспаление печени. Saroglitazar получил статусы Orphan Drug и Fast Track от FDA США для лечения ПБХ.
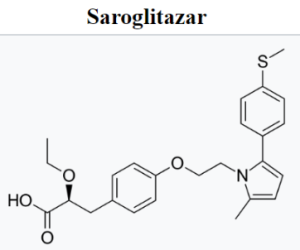
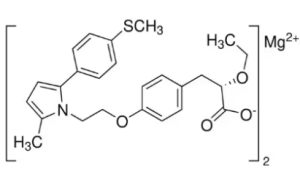
Сароглитазар магния – это действующее вещество препарата сароглитазар, используемого для лечения диабетической дислипидемии (нарушения обмена липидов при диабете) и неалкогольной жировой болезни печени (НАЖБП). Сароглитазар является ингибитором рецепторов, активируемых пролифераторами пероксисом (PPAR), и помогает снижать уровень триглицеридов и глюкозы в крови.
О компании Zydus Therapeutics
Zydus Therapeutics — специализированная биофармацевтическая компания, находящаяся на клинической стадии разработки, которая занимается разработкой инновационных методов лечения редких и серьёзных заболеваний печени, включая первичный билиарный холангит (ПБХ) и неалкогольный стеатогепатит (НАСГ). Будучи дочерней компанией Zydus Lifesciences в США, Zydus Therapeutics использует глобальную сеть из более чем 1300 исследователей и более 30 производственных площадок для разработки инновационных методов лечения. Штаб-квартира Zydus Therapeutics находится в Пеннингтоне, штат Нью-Джерси.

О компании Zydus Lifesciences
Компания Zydus Lifesciences Ltd. является инновационной глобальной компанией в области наук о жизни, которая занимается разработкой, производством и продажей широкого спектра медицинских препаратов. В компании работает более 28 000 человек по всему миру, включая 1500 учёных.
Источник: https://www.prnewswire.com/
Источник: https://www.zyduslife.com/
2.09.2025